
来源:药明康德
我们的一生从一枚小小的受精卵开始,经历一系列细胞分裂、分化,产生各种组织、器官,最终发育成胎儿。这个过程很大程度上依赖于神奇的胚胎自我组织(self-organization)潜能。这一精巧而复杂的过程是如何完成的,则是一个困扰了几代发育生物学家的重要问题。
该问题的答案在医学领域有着重大意义——不仅能为革新检测、预防和治疗先天性遗传缺陷的临床实践提供理论支撑,还将指导以干细胞为基础的细胞治疗,修复疾病或衰老导致的器官损伤。然而,受限于伦理和胚胎获取的技术困难,生物学家对孕后2~3周内的胚胎发育知之甚少。因此,如何在体外模拟如同“黑匣子”的早期胚胎发育过程,成了近年来各国科学家不懈努力的方向。

2023年7月20日,美国得克萨斯大学西南医学中心的吴军团队在《细胞》(Cell)杂志在线发表研究论文,报道了一种基于3D培养可产生胚胎和胚外组织的干细胞,成功在体外模拟了2~3周的人类早期胚胎发育。
人类胚胎在受精后8~10天,囊胚的滋养层细胞与子宫内膜上皮接触,完成着床过程。同时,囊胚内部的内细胞团发育成上胚层和下胚层。其中上胚层最终发育成胎儿;而下胚层将发育成胚外结构卵黄囊,在早期为胚胎提供养分和血液。
进入受精后的第14天左右,胚胎发育的另一个关键事件——原肠胚运动(gastrulation)开启,胚胎逐渐发育成为具有内胚层、中胚层和外胚层的三胚层阶段。其中,外胚层最终发育成为神经系统、皮肤等组织;中胚层发育成为心脏、血液、肌肉和骨骼等组织;内胚层则发育成为肺、肝脏、胰腺和肠道等内部器官。因此,原肠胚运动奠定了器官发育的基础;相反该阶段的异常可能导致妊娠失败或多种出生缺陷。
然而,目前模拟人类原肠胚运动的体外干细胞模型都存在一项关键的缺陷——缺少胚胎发育、形态发生和图式形成必不可少的胚外组织,例如卵黄囊和胎盘。
为了克服上述障碍,吴军团队选择对扩展潜能干细胞(expanded pluripotent stem cell, EPSC)进行培养。相比于传统多能干细胞,EPSC具有分化为胚胎及胚外组织的潜力,并且在小鼠研究中已经得到证实。
在最新研究中,吴军团队首先借助早先开发的一种特殊培养条件,将EPSC转变为上胚层样细胞和下胚层样细胞。这两类细胞随后展现出惊人的自我组织行为,逐步变化为类似双胚层阶段,三胚层阶段,直到早期器官生成阶段的类胚胎结构。这一过程高度还原了人类胚胎在体内的发育过程。
具体而言,首先在类双胚层阶段,上胚层样细胞和下胚层样细胞分别产生类似羊膜腔和卵黄囊的空腔。其中羊膜腔分别由顶部的羊膜样细胞和上胚层样细胞环绕。包括人类在内的灵长类胚胎发育过程中,羊膜细胞充当了发育信号中心的角色,其分泌的信号分子会诱导上胚层开始原肠胚运动,从而产生原始的三胚层细胞。
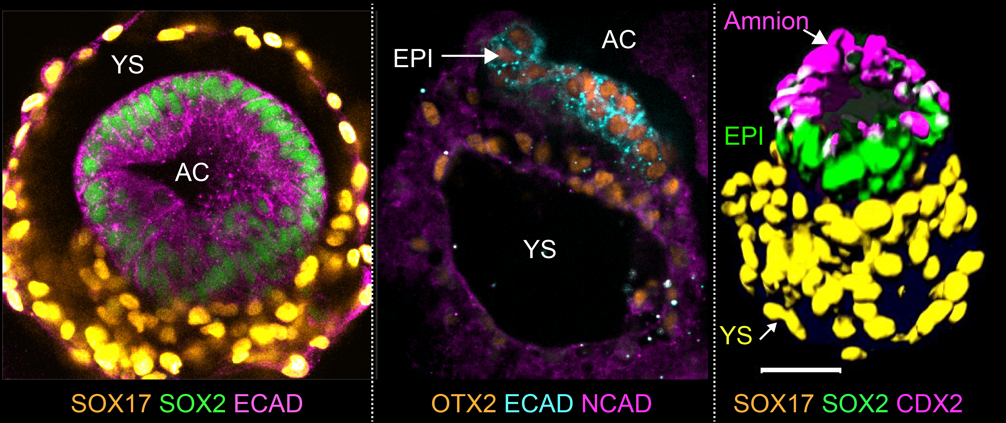 ▲双胚层阶段:左图为俯视图,中间及右图为侧视图。羊膜腔(AC);蛋黄囊(YS);上胚层(EPI)。比例尺:50 微米。(图片来源:吴军团队)
▲双胚层阶段:左图为俯视图,中间及右图为侧视图。羊膜腔(AC);蛋黄囊(YS);上胚层(EPI)。比例尺:50 微米。(图片来源:吴军团队)
接下来,研究者又观察到这一类胚胎结构继续发育成三胚层结构,并伴随原条(primitive streak)的形成。原条是中胚层和内胚层分化的过渡结构,此次为首次在体外成功模拟。这一发现也从侧面印证了羊膜细胞作为胚胎原肠胚运动信号发令枪的角色。
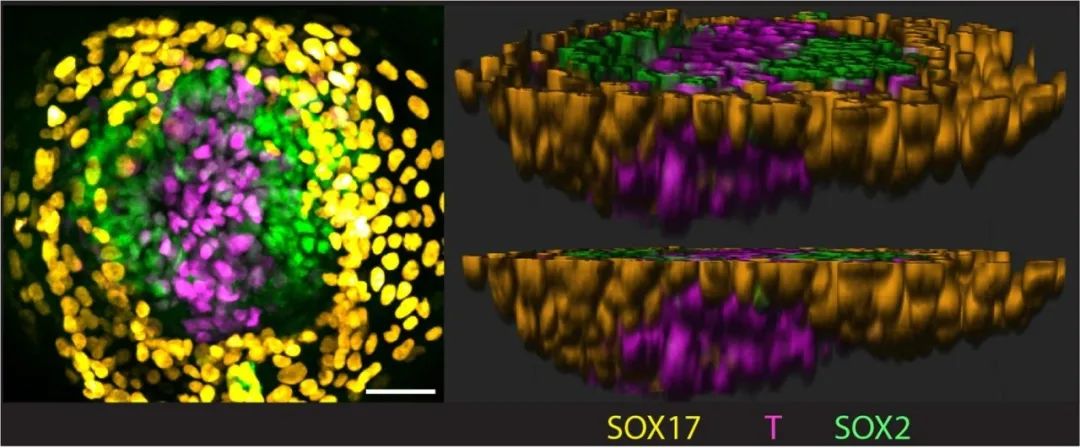 ▲三胚层阶段:该阶段的形态特征是原条结构,如图中粉色细胞所示。左图为俯视图,右图为不同角度的侧视图。比例尺:50微米。(图片来源:吴军团队)
▲三胚层阶段:该阶段的形态特征是原条结构,如图中粉色细胞所示。左图为俯视图,右图为不同角度的侧视图。比例尺:50微米。(图片来源:吴军团队)
接下来的问题是,这一类胚胎结构是否可以继续往后发育?在此前的研究中,模拟到原肠胚运动初期似乎是一个重要技术瓶颈,由此往后的发育未见报道。而在最新论文中,研究者发现他们的类胚胎模型并未止步于原肠胚运动初期。
胚胎发育进入第三周之后,胚胎的复杂程度将迅速增加。例如,一方面位于胚胎尾部的上胚层处会产生神经-中胚层前体细胞(neuromesodermal progenitor, NMP),它们将发育产生脊髓以及副轴中胚层。脊髓的重要性不言自明。副轴中胚层在胚胎发育中也起着重要作用,会发育成分节体并参与躯干骨骼、肌肉、真皮以及血管等的发育。另一方面,在胚胎的头部,外胚层细胞开始向神经外胚层分化,这是中枢神经系统发育的起始。
在此项研究中,研究者观察到他们的胚胎模型出现了神经外胚层以及分节体的特征。接下来,他们通过对胚胎模型的单细胞RNA测序,以及与真实人类和非人灵长类胚胎在单细胞水平的对比。结果,类胚胎在结构上展现了符合预期的高度复杂性,并与同时期的人类胚胎存在解剖结构上的相似性。由此,研究者从发育过程及最终形态上确认,这一类胚胎模型与真实胚胎存在高度相似性。
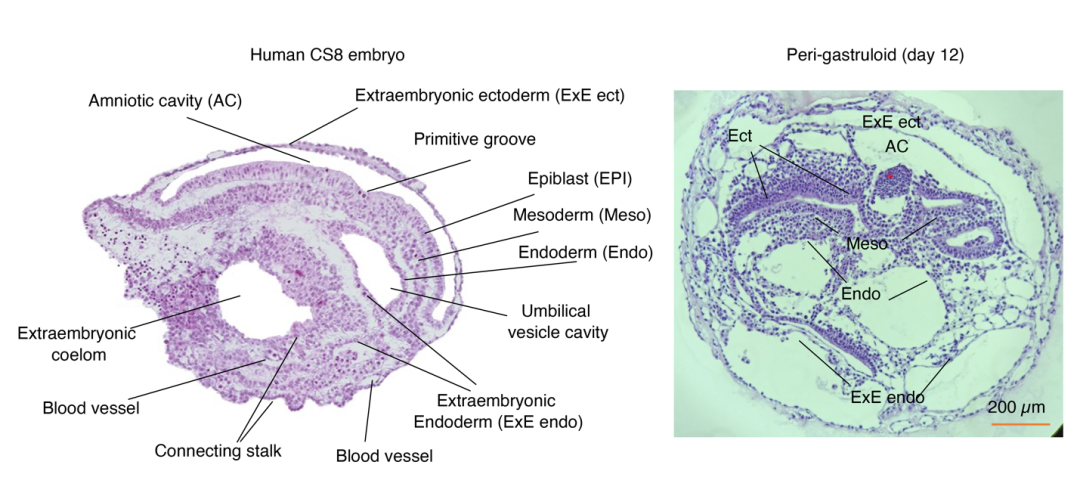 ▲单细胞水平的分析验证了类胚胎模型与真实胚胎的相似性。左图为来自一颗CS8人类胚胎的组织学切片;右图来自第12天的类胚胎的组织学切片。比例尺:200 微米。(图片来源:吴军团队)
▲单细胞水平的分析验证了类胚胎模型与真实胚胎的相似性。左图为来自一颗CS8人类胚胎的组织学切片;右图来自第12天的类胚胎的组织学切片。比例尺:200 微米。(图片来源:吴军团队)
综上所述,该研究描述了一种高效的方法,可以促使人类扩展潜能干细胞自组织成胚胎样结构(peri-gastruloids),重现了人类早期发育的关键阶段,如形成羊膜和蛋黄囊腔、产生双层和三层胚盘、出现原始生殖细胞、启动原肠胚运动,以及早期神经管化和器官形成。单细胞RNA测序揭示了此类胚胎与人类和非人灵长类动物胚胎细胞类型之间的转录组相似性。
对于下一步的研究计划,吴军教授表示:“我们计划进一步完善这种胚胎样结构,特别是与辊胚培养系统的结合,为早期器官发生阶段之后的深入研究奠定基础。这最终可能导致用于再生医学应用的人体组织和器官的产生。”
吴军教授介绍道,这项研究严格遵循国际干细胞研究学会(ISSCR)发布的2021年干细胞研究和临床转化指南,得克萨斯大学西南医学研究中心干细胞监督委员会(SCRO)也根据2021年ISSCR指南规定的条件对该研究进行了全面审查和批准。由于没有胎盘组织,这些类胚胎不能长期体外存活,这也帮助减少了伦理方面的担忧。此外,这些胚胎模型在体外培养时间被仔细校准到检查原肠胚形成和人类发育器官发生的初始阶段所需的最短时间。
得克萨斯大学西南医学中心吴军实验室主导了此项研究,助理讲师刘立中为该论文第一作者。该医学中心的Gary C. Hon实验室,以及宾夕法尼亚大学的Nicolas Plachta实验室共同参与了此项研究。
吴军实验室利用种间嵌合体和干细胞模型研究基础生物学问题和开发再生医学的新应用,目前专注于衍生新型多能干细胞,识别和克服异种障碍,研究多能性的新型调节因子,并生成基于干细胞的哺乳动物胚胎模型。
参考资料:[1] L.Z. Liu et al., Modeling post-implantation stages of human development into early organogenesis with stem-cell-derived peri-gastruloids. Cell (2023). Doi: 10.1016/j.cell.2023.07.018