
来源:医麦客
近日,两家专注于iPSC研发的企业宣布了各自在该领域的进展。
IPS HEART:ISX9-CPC
IPS HEART宣布了其在研iPSC候选产品ISX9-CPC获得FDA授予的儿科罕见病资格认定(RPDD),用于治疗与Danon病相关的心肌病。据悉,本次也是IPS HEART获得的第3个RPDD称号。
Danon病是一种罕见的遗传性疾病,会导致肌营养不良、心肌病和智力低下等一系列症状。其中,心肌病是丹农病最常见的症状,往往会导致死亡,而心脏移植是目前唯一的治疗选择。但心脏移植面临着缺乏器官来源、存在排斥反应、需要长期服药等一系列问题,尚存在着较大的临床需求。
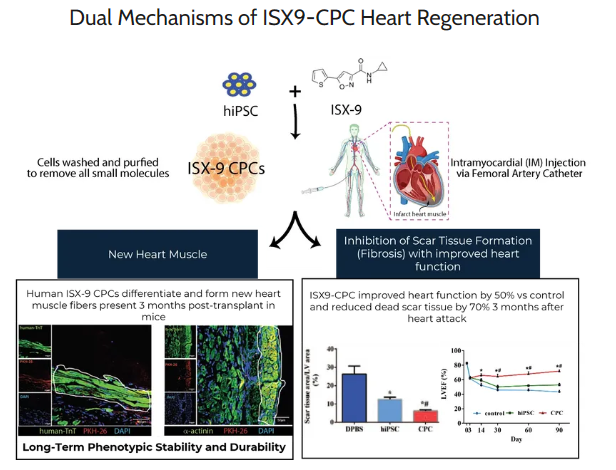
▲ ISX9-CPC(图片来源:官网)
针对这一临床需求,IPS HEART研发了一种小分子iPSC平台,能够利用小分子诱导iPSC重编程为目标细胞。ISX9-CPC是IPS HEART专利平台研发的第一个候选药物,它使用小分子ISX-9将iPSC重新编程为新的功能性心肌,同时减少心脏纤维化,用于治疗Danon病相关心肌病和杜氏肌营养不良(DMD)相关心肌病。在临床前研究中,相较于对照组,ISX9-CPC能够将心脏疤痕组织减少了70%,心脏功能恢复了60%以上。
基于IPS HEART专利平台研发的第二款产品是GIVI-MPC,这是一款用于治疗杜氏肌营养不良患者的“First-in-class”iPSC干细胞治疗药物,它使用小分子Givinostat将人类iPSC重新编程为新的骨骼肌组织,同时能够向DMD患者输送全长的人肌营养不良蛋白,曾在获得FDA授予的儿科罕见病资格认定和孤儿药称号。
GIVI-MPC已经成功地在mdx小鼠和营养不良猪中创造了具有100%全长人类肌营养不良蛋白的人类骨骼肌。虽然较新的DMD基因治疗方法有很大的希望,但是迄今为止还没有缓解潜在的疾病,因为基因治疗只能提供一小部分dystrophin基因(约30%),而不能产生任何新的骨骼肌,因此潜在的疾病还没有逆转。而这一药物在dystrophin基因上取得了突破。
LIfT BioSciences:免疫调节性α中性粒细胞(IMANs)
LIfT BioSciences在近日宣布利用iPSC产生的IMANs成功进行了概念验证生产。
IMANs是一种独特的增强型中性粒细胞,也是首个靶向实体瘤的中性粒细胞治疗产品。具有独特的双重作用模式,既可以直接杀死癌细胞,也可以间接地通过招募患者自身的免疫细胞来杀死癌细胞,通过调节肿瘤微环境(将冷肿瘤变成“热”)。该公司的第一代平台N-LIfT是造血干细胞(HSC)衍生的,用于其同种异体HSC衍生的IMAN产品研发,目前已经进入临床,计划将在2024年H1开始试验。
这次概念验证生产是基于公司的第二代iN-LIfT平台,由iPSCs产生的α中性粒细胞能够被肿瘤释放的趋化因子激活,并且细胞会主动破坏癌细胞。本次概念验证的结果使公司能够生产更具可扩展性和成本更低的同种异体IMANs疗法,有望用于不同类型的癌症患者。
LIfT BioSciences首席执行官Alex Blyth表示:“我们的专利生产工艺非常简单,不需要饲养层细胞或昂贵的磁珠富集,我们设计的IMANs旨在克服其他细胞疗法存在的挑战,现在可以利用iPSC制造,将向着使治疗癌症变得负担得起迈进一步。同时iPSC IMANs巩固了公司的快速上市商业战略,在第一代进行了临床试验后,我们将把第二代产品直接推到Ib/II期试验。”
国内iPSC领域达成多项“首个”
iPSC作为极有潜力的研究方向,近期国内在该领域也取得了众多进展,并创下了多个“首个”。
今年6月,霍德生物自主研发针对缺血性脑卒中偏瘫后遗症的iPSC来源细胞药物产品hNPC01注射液获CDE临床试验默示许可。据悉,hNPC01注射液是全球首个IND申报获批的多能干细胞衍生前脑神经前体细胞产品,也是中国首个获得CDE临床默许的神经类iPSC细胞产品。
该候选产品是基于霍德生物特有的第二代神经分化专利技术(RONA2.0)由该GMP iPSC细胞株工作库分化而来的临床级人前脑神经前体细胞。在临床前研究中,已经展现出了较好的应用潜力。霍德生物未来也将继续探索拓宽该候选产品的适应症。
5月份,睿健医药的“人源多巴胺能前体细胞注射液”(NouvNeu001)的IND获得CDE受理。NouvNeu001是睿健医药通过其自研的高效化学小分子诱导功能细胞再生技术开发的一款针对帕金森病(PD)的iPSC衍生药物,将健康的多巴胺神经前体细胞植入病灶部位,可以弥补多巴胺能神经元的不足。此外这类前体细胞除了能够分泌多巴胺这类递质之外,还可以进一步分泌多种蛋白及小核酸来改善PD病灶,为移植到脑部的细胞发挥作用提供良好的“土壤”环境。值得一提的是,睿健医药是国内首家在PD领域iPSC衍生药物临床申请获得受理的生物医药公司。
4月份,中盛溯源的“NCR300注射液”获批临床,拟开展针对骨髓增生异常综合征(MDS)的临床试验,这是国内首个获批临床的iPSC来源的自然杀伤细胞(iNK)疗法。
总结
iPSC可以应用的范围非常广阔,且由于其独特的优势,iPSC来源的细胞疗法有望降低成本,有利于未来公司在推进产品上市后的商业化进程。我国在iPSC领域的发展速度非常快,已有多项候选产品进入临床,且持续发挥自主创新能力,填补了国内不同细分领域的空白。