EN

来源:启函生物
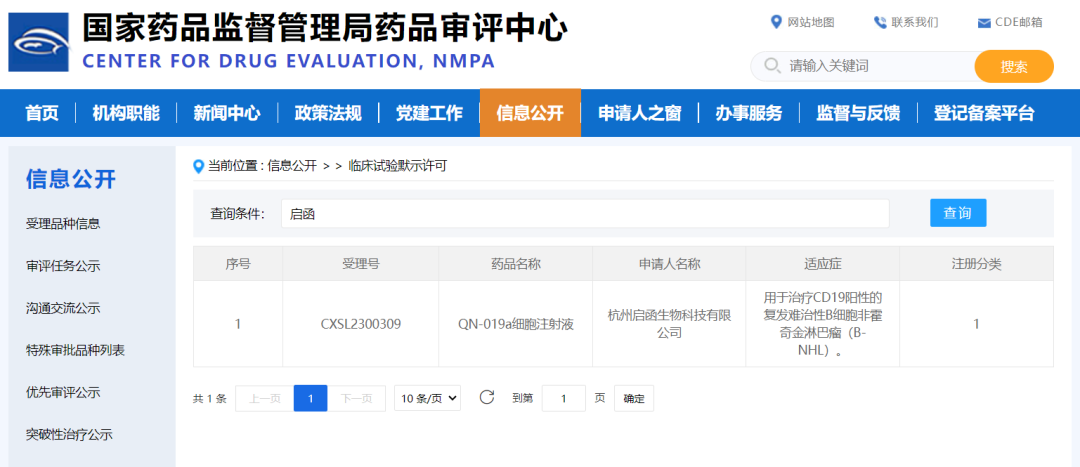
2023年7月18日,启函生物,一家致力于将高通量基因编辑技术应用于细胞治疗和器官移植领域的生物科技公司,今日宣布其产品QN-019a的临床试验申请已获得国家药品监督管理局的临床试验默示许可,这是中国第一个获批的基因编辑iPSC来源的细胞治疗产品。
启函生物运用多位点基因编辑技术修改人源多能诱导干细胞(iPSC),并将其分化成为靶向CD19阳性B细胞肿瘤的自然杀伤细胞(NK)产品QN-019a,其临床适应症为CD19阳性的复发难治性侵袭性B细胞非霍奇金淋巴瘤。据国家药监局药品审评中心官网显示,2023年7月18日,QN-019a细胞注射液的临床试验申请已获得默示许可。
启函生物创始人兼首席执行官杨璐菡博士表示:“这次新药临床试验申请获批是团队多年共同努力的结果,也标志着启函的药学、非临床和临床已经进入一个新的阶段。IND 申报默许只是做药万里长征第一步,我们将坚持科学踏实的原则,充分利用我们基因编辑的技术和深入的生物学知识继续专研,做出对患者长期有效的货架型细胞治疗药物,实现启函的愿景。”
启函生物简介
启函生物于2017年成立于中国杭州,是一家将高通量基因编辑技术应用于细胞治疗和器官移植领域的生物科技公司。启函生物希望利用其高通量的基因编辑技术和对免疫移植知识的深刻理解开发出免疫兼容的同种异体细胞治疗和异种器官疗法,为世界上千千万万的病人及家属带来希望。启函生物累计融资金额超1亿美元,目前公司的同种异体细胞治疗产品已开展研究者发起的临床试验,其中一款产品已获得国家药品监督管理局临床试验默示许可。