
来源:细胞世界
肝移植是治疗急性肝衰竭、终末期肝病、原发性肝癌和某些遗传性肝脏疾病唯一有效的方法,但相对于实际需求,肝脏的供给存在很大缺口。因此,许多患者和家属不得不苦苦等待肝源,十分煎熬。
作为器官移植的替代方法,肝细胞移植备受关注。肝细胞移植已经取得了一些显著的成效,但另一方面,人们在肝细胞移植时通常使用的原代人肝细胞(primary human hepatocytes,PHHs)数量少且难以进行体外扩增。于是研究人员将目光投向了人多能干细胞(human pluripotent stem cells,hPSCs)——它可以无限扩增并分化为包括肝细胞在内的任何类型细胞。
接下来,我们就来看看人多能干细胞向
肝细胞分化的临床应用前景如何。
01 疾病建模
从患者活检组织中获得的hiPSCs可以在体外分化为肝细胞,我们将其称为多能干细胞来源的肝样细胞(PSC-derived hepatocyte-like cells,PSC-HLCs),它可以用于一些遗传病的体外建模,例如科学家们通过使用hiPSC-HLCs建立类器官成功模拟了遗传病如α-1抗胰蛋白酶缺乏症和囊性纤维化等[1]。除单基因突变疾病外,iPSC-HLCs类器官与游离脂肪酸的联合处理还可以模拟非酒精性脂肪性肝病的脂质堆积和纤维化过程。
02 毒理学研究
HLCs可以保留一些供体细胞的特征表型,对罕见的表型进行可重复建模,它还兼具PHH的代谢能力以及癌细胞系的增殖能力和重复性,因此使用HLCs作为体外肝脏模型进行毒理学研究具有良好的应用前景。值得注意的是,在体内观察到的毒性反应是由不同细胞类型之间复杂的相互作用介导的,使用单一肝细胞培养物模拟药物诱导的肝毒性作用有限,将HLCs与支持细胞共培养可以在一定程度上延长其肝功能的维持。
03 药物筛选
药物筛选,即用于研发可以选择性地与基因和基因产物相互作用的药物,或者可以干扰特定分子机制的药物,以便将这些药物用于人类临床试验。药代动力学和药效动力学知识的运用在药物筛选中至关重要。在使用2D模型筛选的过程中,塑料吸附等现象可能会影响剂量和药物效应的关系。相比较而言,三维球体、类器官和器官芯片更适合用于研究药物的药代动力学曲线。
04 生物人工肝
生物人工肝的原理是将患者血浆通过体外循环与生物反应器中的人肝细胞进行物质交换,短时间替代肝脏工作,并促进受损肝脏再生修复,由此帮助部分肝衰竭患者恢复肝功能。生物人工肝需要大量的肝细胞来维持患者的血液透析和肝脏功能,PSC-HLCs可以作为其中的生物成分使用,但它们的长期生存能力低、生产成本高,这些因素都阻碍了其快速应用。
05 组织工程
由于健康供体组织的数量有限以及组织排斥反应存在的风险,再生医学的应用受到了一定程度的限制,使用同基因或人类白细胞抗原相容的hiPSC-HLCs则可以克服这一障碍。一种方法是将hiPSCs接种到脱细胞的人肝细胞外基质支架上进行分化,与标准分化条件相比,使用肝脏脱细胞支架会导致肝功能标志物上调,一些转录因子和核因子的表达水平与成人PHH相当[2];另一种方法是使用PSC衍生的类器官[3]。然而对于类器官移植而言,如何在冷冻保存后,仍然能制备可扩增的、重复性高且稳定的类器官模型是最后的关键挑战。最近的一项研究报道称,hESC来源的类器官可以扩增20代,并且能稳定地保持双潜能前体细胞的表型特征[4]。在小鼠体内移植后,它们可以分化为有功能的肝细胞或胆管上皮细胞,并展现出显著的再殖能力。
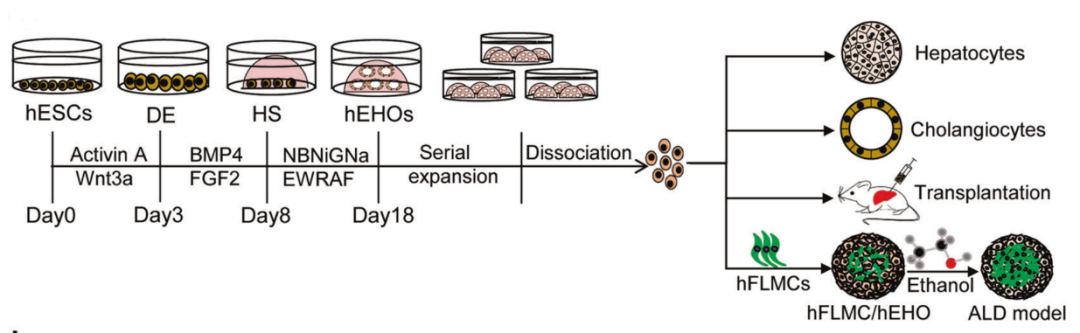
图1 通过模拟胚胎肝脏发育,诱导hESCs逐步分化为肝细胞
此外,有研究者把hiPSCs来源的细胞组成的肝芽异位移植到免疫缺陷的小鼠身上,发现肝芽可以快速地与小鼠的血管连接并且在10天之后开始正常运作,移植到小鼠体内的肝芽在代谢方面与成人肝脏具有相似性。研究人员将肝芽移植到ALF小鼠模型中,发现与对照组相比,ALF小鼠存活率提高,这表明移植到体内的肝芽具有肝脏自我修复能力,可作为桥梁发挥治疗作用。
可以想见,随着人多能干细胞向肝细胞分化的应用研究继续走向深入,它还将给人们带来更多的突破和希望。
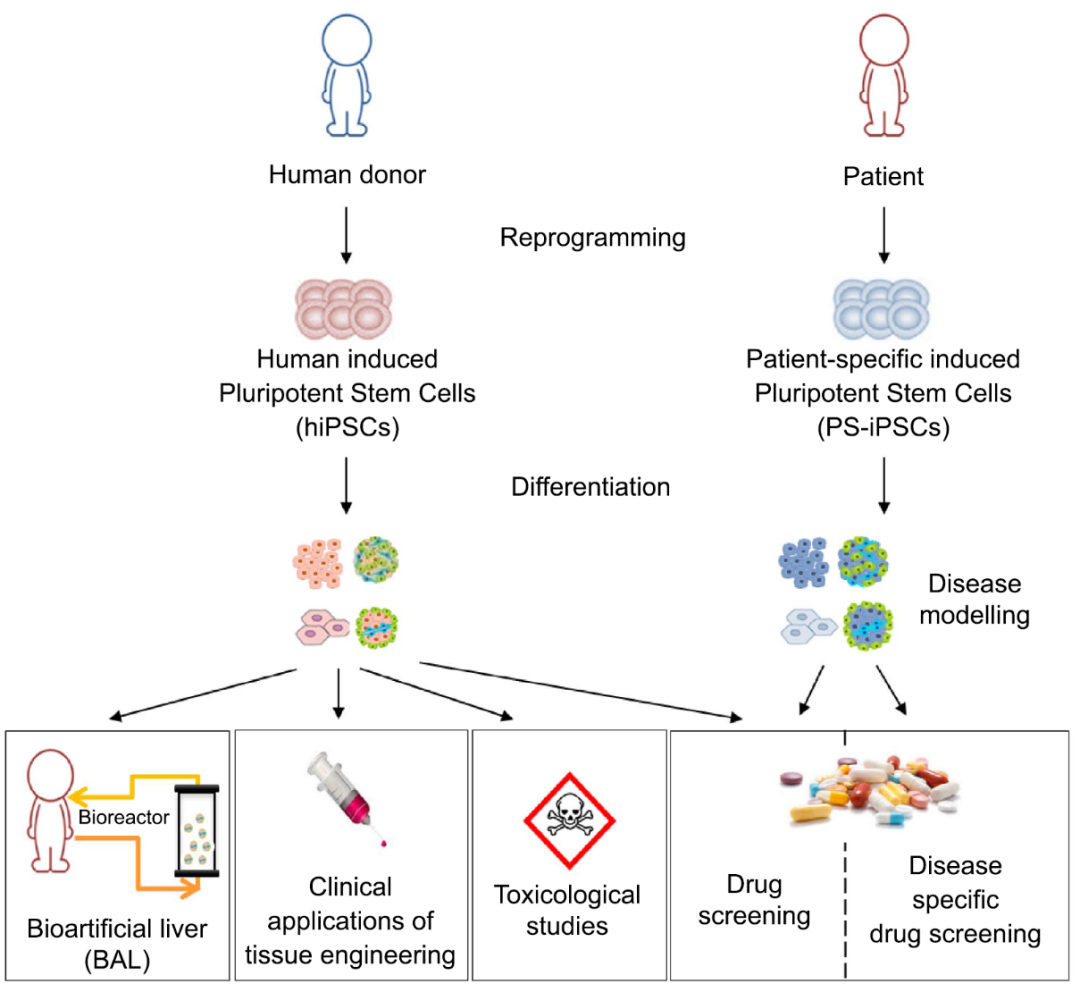
 图2 hPSC分化为肝细胞的应用
图2 hPSC分化为肝细胞的应用
参考文献:
1. Sampaziotis, F., et al., Cholangiocytes derived from human induced pluripotent stem cells for disease modeling and drug validation. Nat Biotechnol, 2015. 33(8): p. 845-852.
2. Jaramillo, M., et al., Decellularized human liver extracellular matrix (hDLM)-mediated hepatic differentiation of human induced pluripotent stem cells (hIPSCs). J Tissue Eng Regen Med, 2018. 12(4): p. e1962-e1973.
3. Takeishi, K., et al., Assembly and Function of a Bioengineered Human Liver for Transplantation Generated Solely from Induced Pluripotent Stem Cells. Cell Rep, 2020. 31(9): p. 107711.
4. Wang, S., et al., Human ESC-derived expandable hepatic organoids enable therapeutic liver repopulation and pathophysiological modeling of alcoholic liver injury. Cell Res, 2019. 29(12): p. 1009-1026.
5. Takebe, T., et al., Massive and Reproducible Production of Liver Buds Entirely from Human Pluripotent Stem Cells. Cell Rep, 2017. 21(10): p. 2661-2670.
6. Luce, E., et al., Advanced Techniques and Awaited Clinical Applications for Human Pluripotent Stem Cell Differentiation into Hepatocytes. Hepatology, 2021. 74(2): p. 1101-1116.