
来源:医麦客
与CAR-T细胞相比,CAR-NK细胞因其多重杀伤机制、更高的安全性和广泛的供源备受关注,目前的研究已经证明了其中的安全性和可行性,NK细胞介导的免疫疗法已成为一种便捷有效的癌症治疗方法。

与T细胞的杀伤作用机制不同,NK细胞仅凭对靶细胞的识别便可启动杀伤过程。NK细胞的杀伤活性受细胞表面的抑制性受体和激活性受体的共同调控,当激活与抑制的平衡被打破,NK细胞便会行使相应的功能。当靶细胞表面表达足够的抑制性配体时,NK细胞的功能是受到抑制的;而当靶细胞表面的激活性配体表达量发生上调、或当靶细胞表面的抑制性配体的表达水平发生下调时,NK细胞的杀伤功能就会得到激活。
NK细胞主要通过三种机制杀伤靶细胞:1.通过释放含有穿孔素和颗粒酶的细胞质颗粒直接杀伤靶细胞;2.释放细胞因子,如IFN-γ、TNF-α等,通过与肿瘤细胞表面相应受体的相互作用诱导肿瘤细胞凋亡;3.Fc受体CD16与抗体的Fc段结合,可激发介导抗体依赖性细胞毒性(ADCC)来杀伤细胞。
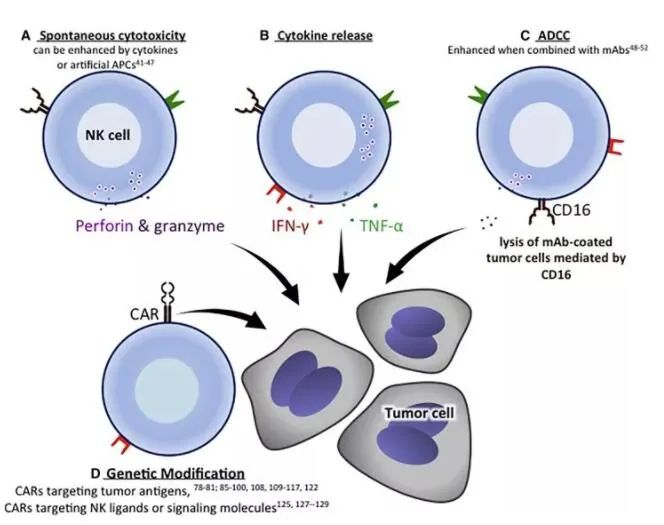
▲ NK细胞介导的肿瘤细胞毒性机制
而诱导多能干细胞(iPSC)是由山中申弥于2006年将转录因子引入细胞形成,这项技术与NK细胞结合后,衍生的iPSC-NK具有更加成熟的表型和有效的细胞溶解活性,且iPSC提供了可以扩展到临床规模的同质CAR-NK细胞群。因此,CAR-iNK细胞成为用作癌症免疫治疗的标志性“现存”产品。
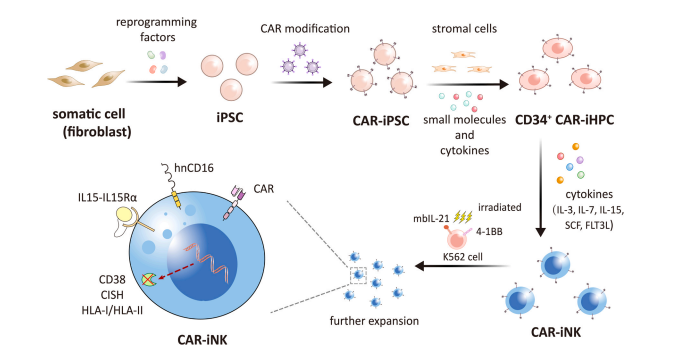
▲ iPSC衍生的CAR-NK细胞的产生
强化iPSC-NK细胞功能有以下策略
融合构建体增强安全性
IL-15是NK细胞存活的必要条件,但在NK细胞培养的过程中会导致外周NK细胞扩增并诱导IFN-γ表达,从而导致全身毒性。因此研究人员利用了iPSC易进行基因改造的优势,将特定的融合构建体(IL-15RF)导入iPSC中,通过修饰iPSC来进一步增强NK细胞的功能,从而增强iPSC-NK细胞的毒性和持久性。
引入CD16a提高存活率
NK细胞介导的ADCC受到受体CD16a调节,将高亲和力、无法裂解的受体CD16a引入iPSC,提高iPSC-NK细胞对活化诱导的CD16a裂解和ADCC效应的抗性,显著提高恶性血液病和实体瘤异种移植模型的存活率。
基因编辑手段
CD38作为双功能胞外酶而同时具有环化酶和水解酶的活性,广泛作用于多种免疫细胞表面,通过特定的基因编辑使NK细胞具有较强的先天免疫功能、ADCC、持久性以及与适应性NK细胞相关的代谢和转录特征,表现出显著的抗肿瘤活性,种种证据都在支持国内外的医疗机构进一步开发iPSC-NK细胞用于肿瘤免疫治疗。
如何利用CAR工程进一步提高iPSC-NK细胞肿瘤靶向性和细胞毒性
CAR-iNK细胞疗法
嵌合抗原受体可以识别肿瘤细胞上的特异性抗原,激活下游信号传导,该作用已被开发用于进一步改善细胞毒性功能和NK细胞抗肿瘤作用,在规避风险的同时,CAR-iNK细胞疗法也保留了CAR-T细胞疗法的抗肿瘤活性。在异种移植的情况下,细胞因子释放的更少,体内外抗肿瘤活性总体也就更高。CAR-iNK细胞的临床疗效极大鼓舞了国内外的研究人员,各种来源的CAR-iNK细胞的临床试验已经展开,期待CAR-iNK细胞疗法将免疫细胞疗法带入一个新时代。
用CAR构建iPSC细胞用于免疫治疗
iPSC可以与CAR一起进行基因工程改造(CAR-iPSCs)。目前用于NK细胞的大多数CAR结构都针对增强T细胞的活化和增殖来设计,为了优化这类NK细胞的功能,国外一家研究机构设计并筛选了一种NK细胞特异性CAR结构(NK-CAR)。与CAR-T细胞相比,NK-CAR修饰的iPSC-NK(NK-CAR-iNK)细胞能够在卵巢癌异种移植模型中有效地抑制生长并延长存活时间,避免患者体重减轻、器官损伤或出现细胞因子释放综合征。这些结果表明NK-CAR-iNK细胞治疗比传统的CAR-T疗法更安全有效。因此,合适的CAR构建体对于提高CAR-iNK细胞的抗肿瘤能力功不可没。
多功能装备下的CAR-iNK细胞
除了用CAR来设计iPSC以外,许多研究机构也在尝试其他方向的基因修饰以进一步提高CAR-iNK细胞的功能,国外一家机构创建了一个三重基因修饰的CAR-iNK(iDuo-NK)细胞,使其在淋巴瘤和白血病中表现出持久的应答。为进一步探讨CAR-iNK细胞在多发性骨髓瘤中的应用,该机构还设计了一个四倍基因编辑的CAR-iNK细胞,被称为 iDuo-MM-CAR-NK细胞。iDuo-MM-CAR-NK细胞在体内外均表现出持续和持久的抑瘤作用,其抑瘤效果与靶向BCMA的CAR-T细胞相当,但无GVHD等并发症。更重要的是,当与Isatuximab(抗CD38单克隆抗体)相结合时,iDuo-MM-CAR-NK细胞实现了ADCC活性的最大化,对MM的抗肿瘤作用也效果显著。
最近,Century Therapeutics公司开发了一款CAR-iNK细胞产品,通过六次基因修饰,旨在提高持久性、功能性和安全性。使用这种CAR-iNK细胞疗法治疗复发或难治性分化型CD19阳性B细胞恶性肿瘤的I期临床试验正在招募中,以评估其安全性、药代动力学和初步疗效。
CAR-iNK细胞疗法在临床应用中面临的挑战
在符合cGMP的条件下生产iPSC是满足临床规范的必要条件。首先获得用于衍生iPSC的体细胞,对其进行相关传染病病原体或疾病测试(RCDAs),其次CAR-iNK细胞必须通过稳健、可重复和符合cGMP的制造工艺产生。
提高CAR-iNK细胞在实体瘤中抗肿瘤活性的策略
近年来,许多临床前和临床研究已经证明了CAR-iNK细胞用于血液系统恶性肿瘤的可行性和有效性。然而,CAR修饰的免疫细胞在实体瘤中的疗效受到肿瘤抗原异质性、肿瘤浸润受限和免疫抑制肿瘤微环境(TME)的阻碍。在过去的几年里,已经开发了几种方法来改善CAR-T/NK细胞的扩增、持久性、对TME的抗性和代谢适应性,这些方法也可用于CAR-iNK细胞治疗。
改善CAR-iNT细胞的扩增和持久性
IL-15作为NK细胞增殖和维持的重要细胞因子,已被广泛应用于提高CAR-iNK细胞的持久性和细胞毒性。除IL-15以外,IL-12和IL-18细胞因子诱导的记忆样【ML】NK细胞在体内也会表现出增强的抗肿瘤活性和改善的作用。另外对于NK细胞的增殖和成熟,IL-21也同样功不可没。研究人员还发现,在iPSC中敲除HLA-I和II可以逃避异基因T和NK细胞的识别,从而促进基于iPSC的再生医学应用的持续性。
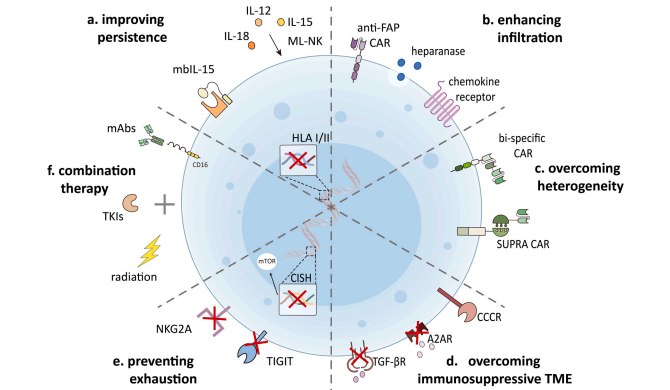
▲ 增强CAR-iNK细胞活性的策略
增强CAR-iNK细胞在实体瘤中的浸润作用
实体瘤中CAR-iNK细胞的浸润不足是限制治疗效果的重要因素。研究人员参考CAR-T细胞分泌乙酰肝素酶等基质降解酶,促进CAR-T细胞的肿瘤浸润和抗肿瘤活性这一策略,用于CAR-iNK细胞治疗以增强其向不同实体瘤的输送。
增加CAR-iNK细胞的肿瘤靶点以克服肿瘤异质性
抗原丢失和肿瘤异质性是导致癌症复发的重要因素,将多种抗原靶向癌症细胞是预防CAR的细胞治疗后抗原丢失的方法之一。除了用靶向不同抗原的CAR-T细胞进行联合治疗外,许多机构已经开发出了双特异性CAR。例如国外开发的由合成Notch(synNotch)受体介导的多抗原启动和杀伤识别通路,通过靶向同质但非绝对肿瘤特异件的抗原,实现了完整可控的肿瘤细胞杀伤。这些技术可能为CAR-iNK细胞成功靶向异质性肿瘤提供类似的方案,同时最大限度地减少肿瘤内外的毒性。
基因工程CAR-iNK细胞克服免疫抑制肿瘤微环境(TME)
CAR-iNK细胞必须面临不利的代谢条件包括缺氧、酸性pH和低血糖水平,以及可能损害NK细胞功能的免疫抑制细胞。作为最重要的免疫抑制细胞因子之一的转化生长子β(TGF-β)缺氧状态下通常会以多种方式损害NK细胞的功能。带有TGF-β抗体或抑制剂的CAR-iNK细胞有望改善NK细胞对免疫抑制TME的抗性。除TGF-β以外,腺苷是另一种关键的免疫抑制代谢产物,限制了细胞毒性淋巴细胞的激活同时还会损害抗肿瘤免疫反应。消融腺苷信号传导或给予A2A腺苷受体(A2AR)拮抗剂可以增强NK细胞介导的抗肿瘤免疫。因此,阻断或切换CAR-iNK细胞中的这些免疫抑制信号通路有助于克服免疫抑制性TME。
调节CAR-iNK细胞的代谢适应度并防止其耗竭
细胞代谢在调节NK细胞功能方面发挥着关键作用。研究人员通过激活mTOR信号通路来改善的代谢适应度,从而增强iPSC-NK细胞的扩增和抗肿瘤功能。此外抑制性受体上调也有助于NK细胞的免疫耐受,但这些改善CAR-iNK细胞功能的策略需要在临床试验中进行进一步验证。
CAR-iNK细胞疗法在联合治疗中的应用
CAR-iNK细胞可以与TKIs、放疗和单克降抗体联合使用,以进一步增强其抗肿瘤作用。
总结
CAR介导的免疫治疗在血液恶性肿瘤和一些实体肿瘤中的成功推动了用于癌症免疫治疗的CAR-iNK细胞的发展。iPSC的优势为增强CAR修饰的iPSC衍生的NK细胞的功能提供了许多机会,使其成为对抗血液系统恶性肿瘤和实体瘤的一把利刃。此外iPSC来源较广,在体外重新编程的增殖潜力十分可观,显著降低了生产成本,使CAR-iNK细胞更有益于临床应用。
参考资料:https://www.biospace.com