
来源:医麦客
2023年9月20日,一名58岁名叫Lawrence Faucette的男性接受了基因改造猪心脏器官的移植手术,是全球第二例移植基因改造猪心脏的患者。FDA基于“同情使用”计划,批准了这项实验性猪心脏异种器官移植手术。9月22日,美国马里兰大学医学院(UMSOM)发布了声明,Lawrence Faucette可以自主呼吸,新的心脏在没有任何辅助设备的帮助下功能也很好。马里兰大学医学院的医生们认为,接受异种移植的患者面临的风险会更大,因此他们将对患者进行密切监测,及时发现一切不良迹象。这次通过基因编辑改造的异种器官的移植可以为患者维持多久的生命力还需要进一步的观察和研究。
基因编辑技术使异体移植成为可能
器官移植主要有两种,一种是“同种异体器官移植”,比如人与人之间的器官移植;还有一种是“异种器官移植”,即从动物身上摘取器官,然后移植到人类身上,这带来了一系列挑战,但有可能挽救许多生命。同时,异种移植有可能将疾病从动物传播到人类,还存在受者的免疫系统排斥异物的风险,这对患者可能是致命的。随着基因技术的发展,像基因编辑技术CRISPR/Case9的出现,使得通过敲除和插入某种基因,有可能可以避免一定程度的免疫排斥,使实现更匹配的异种器官移植供体成为可能。
异种移植猪心脏可能涉及的基因编辑策略包括:敲除免疫显性异种抗原碳水化合物基因,以此抗免疫原(半乳糖-α-1,3-半乳糖(GT)、Sda 血型抗原(B4Gal)和N-乙酰神经氨酸(CMAH));敲除生长激素受体(GHR)基因来减少异种移植的内在生长;同时通过转基因表达补体调节(CD46/膜辅蛋白(MCP))、抗凝(血栓调节蛋白(TBM)和内皮细胞蛋白 C 受体(EPCR))和抗炎(CD47和血红素加氧酶(HO-1))。
全球首例基因编辑猪心脏移植失败
全球首例猪心脏移植到人体手术中用到的猪心脏,是科学家使用基因编辑修改了 10个基因,包括敲除 1 个控制器官生长的基因和3个人类免疫排斥的基因,同时插入了6个使猪心脏可以更好地适应人体免疫系统的基因。
2022年1月7日,57岁的David Bennett在美国马里兰大学医学中心(UMMC)接受了全球首例经过基因编辑的猪心脏移植手术。然而3月8日,David Bennett便去世了。移植到David Bennett体内的猪心生存了仅两个月的时间,没有急性排斥反应的证据。
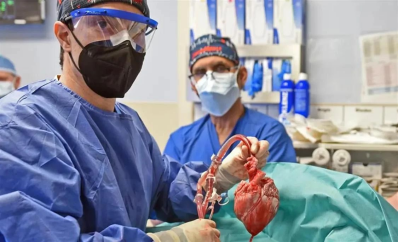
全球首例基因编辑猪心脏移植手术中
2023年6月30日,马里兰大学网站报道,马里兰大学医学院外科学教授、心脏异种移植项目主任穆罕默德·毛希丁,猪心脏移植手术医生巴特利·格里菲思作为主要作者在医学杂志《柳叶刀》上发表一项研究,揭示了世界首例转基因猪心移植失败的可能原因:1.患者在移植前健康状况不佳,限制了移植临床前研究中使用的有效抗排斥方案的使用,同时患者的器官可能更容易受到免疫系统产生的抗体的排斥。2.移植后的第二个月,患者接受了两次注射静脉注射免疫球蛋白(IVIG),以帮助预防感染,也可能引发对猪心的免疫反应。3.猪心脏中可能存在一种名为猪巨细胞病毒(PCMV)的潜伏病毒,在患者减少抗病毒治疗方案后,该病毒可能被激活,引发了导致细胞损伤的炎症反应。然而,没有证据表明该病毒感染了患者或扩散到心脏以外的器官。
全球第二例基因编辑猪心脏移植到人体
如上所诉,研究的关注点仍然停留在抗免疫排斥方向和抗病毒感染方向,因此为了防止人类因抗体介导的排斥反应而对猪器官的快速排斥反应,第二例接受基因编辑猪心脏器官的移植手术中,所使用的供体猪敲除三个基因,以消除猪血细胞中的 α-gal糖,避免引发人体免疫排斥反应;删除了一个基因,防止猪心脏的异常生长;科学家还插入了六个人类基因,以提高人体免疫系统对猪心脏的接受程度。供体猪经历了10种不同的基因编辑。为了避免免疫排斥反应,患者也在接受传统的抗排斥药物和一种新型抗体疗法tegoprubart的治疗,该疗法由Eledon Pharmaceuticals开发,在异种移植排斥反应的动物模型中,tegoprubart已被证明可以延长异种移植器官继续显著发挥作用的时间。
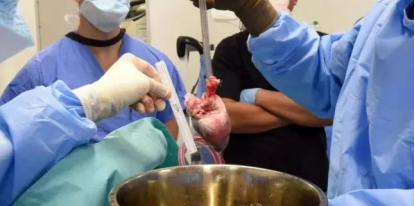
全球第二例基因编辑猪心脏移植手术中
对于抗病毒感染的策略,提供基因工程猪心的生物技术公司Revivicor的科学家使用新开发的、更灵敏的病毒DNA测试,并对供体猪的组织样本进行检测;新增了PCMV的抗体的检测,从是否正在感染和是否曾经被感染过两方面着手,更大程度上避免仍然在细胞深处携带潜伏的病原体。
基因编辑/异种器官移植带来的思考
基因编辑依赖于经过基因工程改造的核酸酶,也称“分子剪刀”,在基因组中特定位置产生位点特异性双链断裂(DSB),诱导生物体通过非同源末端连接(NHEJ)或同源重组(HR)来修复DSB,因为这个修复过程容易出错,从而导致靶向突变。这种靶向突变就是基因编辑。常用的基因编辑技术CRISPR/Cas9 系统主要由Cas9蛋白和单链向导RNA(sgRNA) 所组成,其中Cas9蛋白起切割DNA双链的作用,sgRNA起向导的作用,在sgRNA的向导下通过碱基互补配对原则,Cas9蛋白可对不同的靶部位进行切割,实现DNA的双链断裂。CRISPR/Cas9技术的局限在于同源重组效率低,PAM序列依赖性还有脱靶效应。
基因编辑技术的编辑损伤和可能存在的脱靶效应是否会影响改造后的异种器官质量,从而影响异体移植的成功率?现在还没有确切的研究。
异种移植器官之所以选择猪器官是因为猪与人的体温均为 36℃~37℃,心脏大小、管道分布和动力输出,甚至心率(猪为55~60次/分钟,人的心率为 60~100次/分钟)都相似,且传染病风险较低,数量相对更为充足。在医学界,植入人体细胞的猪的心脏瓣膜已经用于患者治疗,猪的韧带肌腱移植也已经成熟。之所以没有选择与人类“近亲”的灵长类也是综合多方面因素考虑,灵长类中大多数体型较小的,其器官性能和尺寸无法承担人类代谢的需要,而体型较大的,本身处于濒危状态,也难以满足人类对器官移植数量的需求。灵长类繁殖率较低,还可能带有一些人类易感染的病毒,如猴免疫缺陷病毒和埃博拉病毒等,一旦这些器官移植到人体上,发生重组后可能产生更有害的病毒。
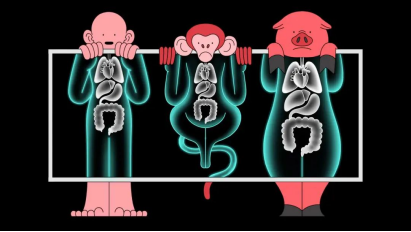
X 光机下人、猴、猪的图解
到目前为止,人类共进行了两次在人体上移植经基因编辑猪心脏的手术,我们看到人们还没有过多将关注停留在考虑猪心脏本身的“寿命”问题,一般猪的寿命在15年左右,那么移植猪器官是否会加速人体老化?而经过基因编辑改造后的猪心脏是否会进一步加速缩短猪心脏本身的“寿命”?如果需要多次不断地移植经过基因编辑改造的猪心脏又是否会在人体引发额外的病毒感染?又是否会加速降低患者本身的免疫抵抗力?
结语
虽然对基因编辑改造的异种移植器官的未来还有很多疑问,但是正如马里兰大学研究小组的异种移植专家Muhammad Mohiuddin博士所说:“看到猪的心脏在人体内工作,感觉太棒了。”“我们不想预测任何事情,我们会把每一天都当成胜利,勇往直前。”