
来源:医麦客
近日,再生医学企业Cellusion宣布其在研“iPSC衍生角膜内皮细胞替代疗法(CLS001)”获得美国FDA授予的孤儿药称号(ODD),用于治疗大疱性角膜病变。这一认定将进一步加速CLS001的全球开发。
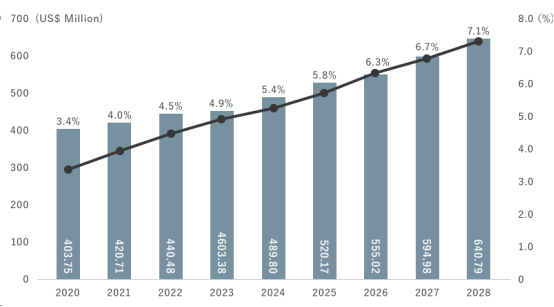
大疱性角膜病是一种由于白内障、眼科手术或遗传因素导致角膜内皮细胞减少而引起的角膜水疱和视力障碍,这种渐进式疾病在得不到有效治疗的情况下可能导致患者失明,而目前的标准疗法是通过角膜移植,替换正常功能的角膜内皮细胞。据公开数据显示,全球范围内约有1300万人在等待角膜移植手术,而每年能够进行的角膜移植手术仅有约18万例。据预测,全球角膜移植市场将从2021年的4.21亿美元增长到2028年的6.41亿美元,复合年增长率估计为6.2%。
CLS001是基于Cellusion专有技术开发的,用于角膜内皮再生的CECSi细胞,有望通过结合“由iPS细胞制成的具有优良增殖特性的CECSi细胞”和“无需专业知识的简单注射细胞输送程序”来改变目前全球性的角膜供体短缺局面。不同于传统角膜移植是利用气压粘附,CLS001疗法则是利用重力粘附,在移植后三小时内必须保持面朝下的状态,其造成的伤口较小,能够显著减少并发症。
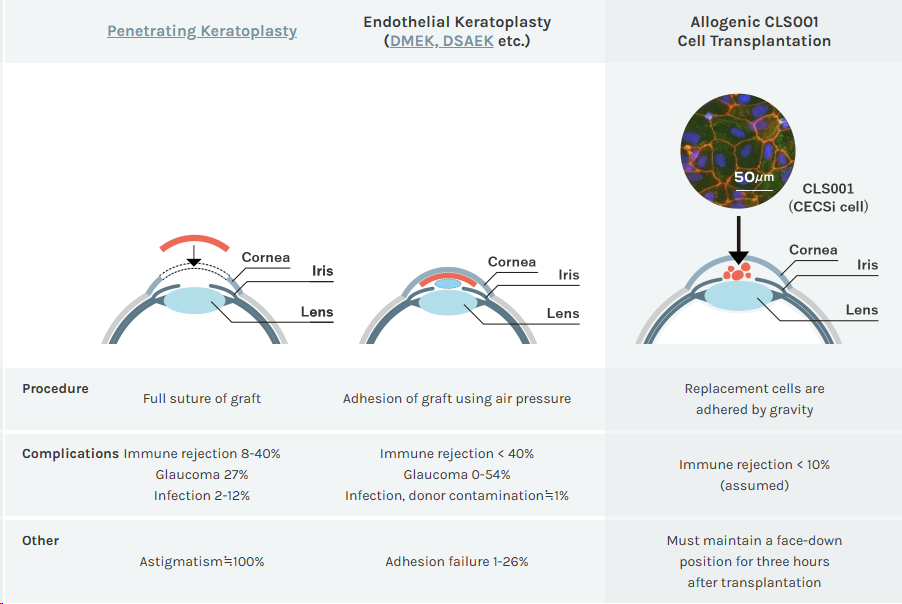
另外,该候选产品解决了当下从 ESC或iPSC产生角膜内皮样细胞的一个局限性。此前的研究曾表明从ESC或iPSC产生角膜内皮样细胞的过程中,需要经历神经脊细胞(NCC)作为中间体的发育过程,这可能会产生包括软骨细胞、脂肪细胞、神经元细胞等在内的多种细胞,不利于大规模制造。而Cellusion专有的技术可以将iPS细胞直接分化为角膜内皮样细胞而无需中间体,这能够有效确保稳定的细胞质量,并有利于细胞快速批量生产。并且,CLS001可以冷冻保存,这意味着移植治疗所需的角膜内皮替代细胞可以提前大量生产和储存,将其运输到各地以便于在患者需要时使用。
此前,Cellusion曾宣布已完成了CLS001的首例患者移植,在2023年1月举行的独立数据监测委员会的审查中,CLS001移植后3个月内没有观察到任何不良事件,并且患者的视力、中心角膜厚度和最小角膜厚度已趋于改善。目前,Cellusion正计划在全球多个地区进行研究。
Cellusion在2015年于庆应义塾大学医学院眼科系诞生,拥有包括从iPSC到CECSi细胞的独特分化诱导方法。2022年1月,Cellusion宣布完成11亿日元的融资;今年6月,Cellusion完成了28.3亿日元的C轮融资,截至C轮融资完成,Cellusion总共筹集了45亿日元(约2.26亿人民币),主要用于推动CLS001在日本和海外的1/2期临床试验。
2022年09月,Cellusion与杭州星赛瑞真生物达成独家许可协议,将包括中国大陆、香港、澳门和台湾在内的大中华地区开发、制造和商业化CLS001的独家权利license out给星赛瑞真生物,并有可能获得超过1亿美元资金,包括预付款、开发里程碑和销售里程碑,以及梯度特权使用费。
星赛瑞真生物是2022年7月创立的,是一家聚焦于细胞治疗和再生医学领域的创新药研发的平台型公司,专注于干细胞相关技术的研发和临床转化,其已经完成了4500万元的种子轮融资,投资方为复星医药旗下孵化基金复健资本新药创新基金。据公开消息披露,星赛瑞真生物主要聚焦于组织再生和肿瘤治疗领域,其组织再生领域的候选产品包括从Cellusion引进的角膜内皮细胞疗法;在肿瘤治疗领域其正在与美国肿瘤细胞疗法领域的顶尖科学家进行合作,共同开发干细胞来源的CAR-NK。
国内iPSC领域近期进展
iPSC是一个颇具潜力的赛道,被应用于再生医学、肿瘤、罕见病等领域。近期,iPSC赛道取得了颇多进展。
三启生物在第65届美国血液学会(ASH)年会上发表了其iPSC来源的靶向GPRC5D的CAR-iNK产品的相关临床前数据。其iPSC来源的CAR-NK细胞纯度超过99%,NK细胞激活受体(NKG2D,NKp30)及共刺激因子(CD226,CD244)表达均超过96%以上。在体外试验中,CAR-iNK经复苏后单次给药,可显著降低Xenograft移植模型小鼠的肿瘤负荷,并提升小鼠生存率。据悉,基于该项目,三启生物结合自身基因编辑平台优势进一步开发出针对MM的首个iPSC来源的第四代CAR-NK产品CIB-315,计划将在2024年申报IND。
12月,睿健医药的“人源多巴胺能前体细胞注射液”获得临床试验默示许可,适应症为发病年龄早于50岁的早发型帕金森病。至此,睿健医药对帕金森领域进行了生命周期、治疗周期完全覆盖的战略布局。
11月,士泽生物全球首发管线临床级iPSC衍生亚型神经前体细胞产品治疗渐冻症获得FDA授予孤儿药称号,是迄今为止全球首个用于治疗渐冻症的拥有孤儿药资格的iPS衍生细胞药。
同月,呈诺医学的异体内皮祖细胞(EPCs)注射液(ALF202)获得临床试验默示许可,拟用于治疗严重下肢缺血。其是基于iPSC定向诱导分化得到的异体内皮祖细胞(EPCs)注射液。呈诺医学还有一款用于治疗急性缺血性脑卒中的iPSC衍生细胞候选产品ALF201注射液已经完成了首例患者给药。
11月,中盛溯源的“NCR300注射液”获批临床,用于预防急性髓系白血病异基因造血干细胞移植后复发,这是今年中盛溯源在iNK细胞疗法斩获的第2项IND,进一步拓展了公司的肿瘤产品管线注册临床试验。
总结
在全球范围内iPSC进展非常快,特别是近几年,可以算是研究成果临床转化的关键节点。而国内也崛起地十分迅速,众多企业在今年将候选管线推进至临床。iPSC领域尽管存在致瘤性、异质性、免疫原性等挑战,不过从已经披露的数据和研究趋势来看,当下企业均重视其安全性,尽可能地开创技术将未分化iPSC的比例降低,同时提升疗效。未来,随着iPSC候选产品愈发在临床中展现潜力,将会吸引更多玩家入局,而产业链也会进一步完善。