
来源:医麦客新闻
近日,小激活RNA(RNAa,saRNA)先驱MiNA Therapeutics公布了其针对胎儿血红蛋白(HbF)的RNAa产品最新的临床前体内研究数据,首次证明了RNAa疗法能够高效地被递送到骨髓中的红细胞祖细胞,有效治疗β-血红蛋白病。造血干细胞领域即将迎来新的基因疗法分支与竞赛。
MiNA的HbF产品旨在增加γ珠蛋白(HBG)基因的转录,使β-血红蛋白病患者产生更高水平的HbF,以作为血红蛋白的代偿形式,有望实现严重遗传性血液病(如镰状细胞病和β地中海贫血)患者的功能性治愈。
在非人灵长类动物体内,MiNA将RNAa复合物封装在脂质体NOV340内,通过静脉注射可输送到骨髓中,实现超过60%的红细胞集落形成单位(CFU-E)细胞和前成红细胞(Pro-E)。在外周血单核细胞中也观察到了同等水平的递送效率。
造血干细胞基因疗法的现状与发展趋势
随着全球首款CRISPR/Cas9基因编辑疗法Casgevy接连获美国FDA批准了两项适应症上市,造血干细胞基因编辑疗法也吸引了更多的目光。
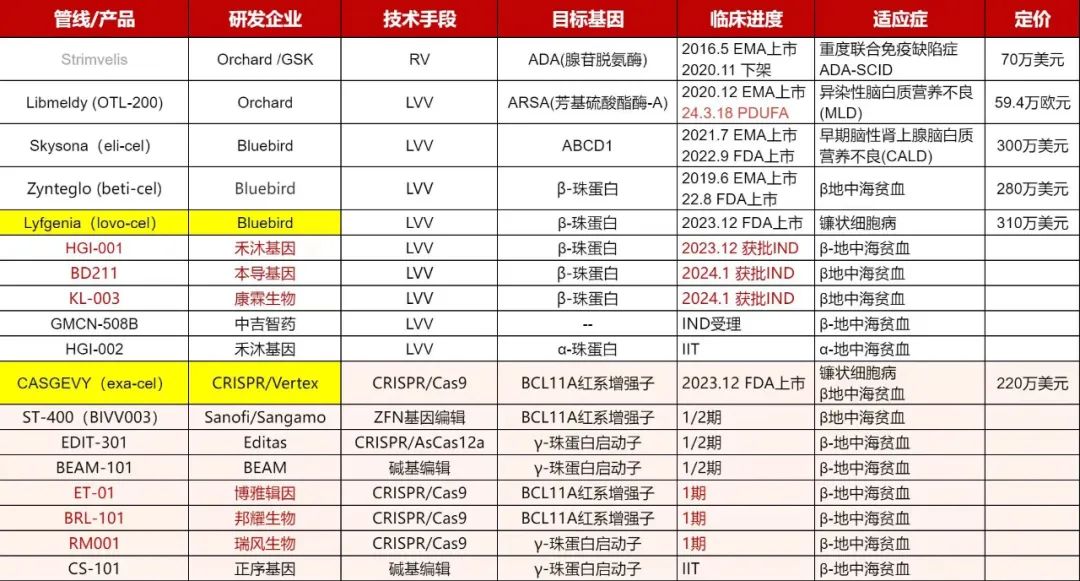
早在2016年,世界首款造血干细胞基因疗法Strimvelis在欧洲上市,随后几年,蓝鸟生物的Zynteglo、Skysona,Orchard的Libmeldy相继上市,获批最多的适应症是地中海贫血。目前地中海贫血临床上常规的治疗方案是定期输血或造血干细胞移植,虽然有效但副作用和伴随的长期治疗需求也给患者造成了极大困扰,而基因治疗则可以较好地避免这些缺点,有望在未来成为该疾病的主要治疗手段,市场前景巨大。
面对已有产品上市的成熟技术在CMC工艺与生产成本方面,逐步克服商业化难题;基因编辑工具不断迭代优化,在精确、简便和高效上加深优势,此时才拿到入场券的RNAa疗法似乎有些没跟上步伐。然而RNAa不改变基因组,利用固有的基因激活机制,小规模恢复或促进基因的正常功能,从而在细胞中的蛋白质调节途径的机制,也在高手如云的基因治疗赛道独树一帜。MiNA在2014年获得saRNA基础专利的许可后,在2016年便开始了全球第一款saRNA药物MTL-CEBPA的临床研究,目前针对晚期肝癌的研究结果十分突出。此次MiNA临床前研究结果的公布,无疑预示着造血干细胞基因疗法领域即将迎来新疗法的冲击,开启新一轮的技术优化与竞速。