
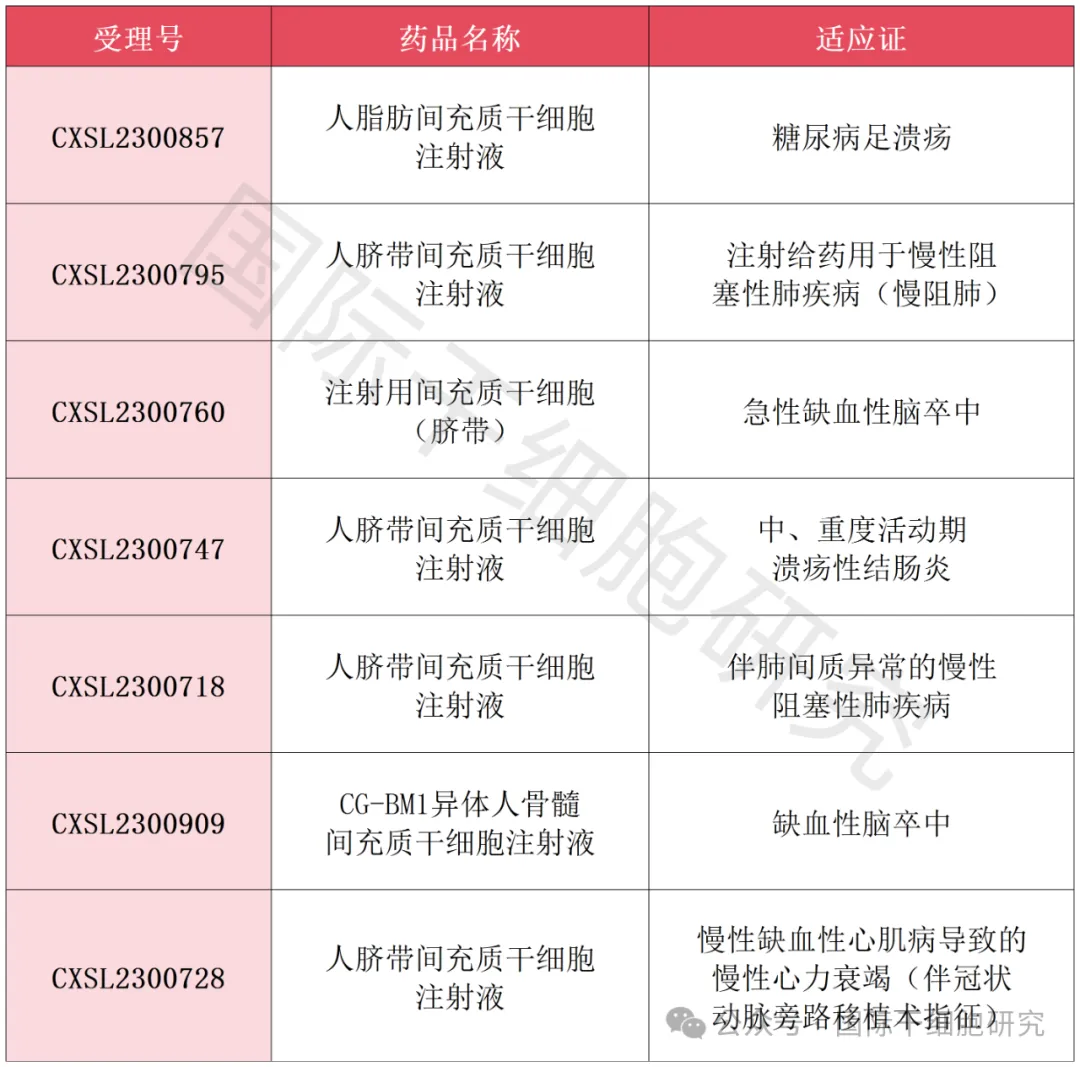
截止到2024年4月底(第一季度),我国已新增7款间充质干细胞(不含造血干细胞)新药IND,获国家药品监督管理局药品审评中心(NMPA)批准,涉及脑卒中、糖尿病足、慢阻肺、溃疡性结肠炎、慢性心力衰竭等多类慢性病的防治。
截至目前,我国共有63项间充质干细胞的新药IND获批,随着干细胞临床试验数量的不断增加,势必会推动我国干细胞产业的蓬勃发展!
干细胞及间充质干细胞知多少
干细胞是一类可分化为多种组织细胞类型,并具有自我更新能力的“原始细胞”,包括胚胎干细胞、诱导多能干细胞、间充质干细胞等诸多家族成员,尤以“间充质干细胞”临床应用更为广泛。
其中,间充质干细胞(MSC)是一类来源于中胚层的多能干细胞,具有组织修复、免疫调节、增殖与分化潜能、血管再生等多重功效,可从机体多个组织器官(如脐带、脂肪组织、骨髓、牙髓等)中分离获得,在慢病防治、美容抗衰、提升机体免疫力等方面具有独特的优势,故又被誉为干细胞中的“全能选手”!
我国干细胞监管政策及新药审批的流程
我国干细胞疗法的监管政策
我国自2019年发布《关于做好2019年干细胞临床研究监督管理工作的通知》以来,开始采取由“国家药监局”和“卫健委”共同监管的干细胞“类双轨管理模式”,以建立符合我国自身国情的干细胞技术规范。
我国又在2022~2023年间,先后颁布了多条法规,包括《“干细胞研究与器官修复”重点专项2022年度项目申报指南(征求意见稿)》、《细胞治疗产品生产质量管理指南(试行)》等,以进一步对干细胞及其相关产品的临床试验、临床应用、生产管理、质量管理等,进行全方位监管。
干细胞新药的审批流程
一款新药从研发到获批上市,通常需要经历临床前研究、3期临床试验、新药IND及NDA申请等必经阶段,只有上述这些审批流程全都顺利通过,才可获批上市,干细胞新药也不例外。很多患者可能都听过“新药IND及NDA”,但并不了解其含义及重要性,下面小编简单介绍一下,以供参考。
1、新药临床研究申请(IND)
当干细胞产品或临床新药顺利通过临床前试验后,需要向美国食品和药物管理局(FDA)或国家药品监督管理局(中国)提交新药临床研究申请。如果FDA在提交申请后的30天内,未驳回申请,则该产品的临床研究申请被视为有效,可以进行相关的临床试验。
据悉,一款名为“JadiCell”的干细胞产品,已向美国FDA提交了Ⅲ期临床试验申请(Clinical Trials Arena),期待能迎来该产品尽早上市的好消息!
2、新药申请(NDA)
该产品在完成全部3期临床试验后,可整理汇总研究资料及数据,之后向美国FDA(或我国药监局)提交新药申请(NDA),以确保上市药物的有效性、安全性、质量可控性。
FDA通常会在6个月的规定时间内,完成该产品的NDA审批。但通常情况下,由于申请材料过多,很多新药的审批获批时间可能更长。
2024年第一季度新增干细胞IND
截至2024年4月底,我国共有7款间充质干细胞(除外造血干细胞)新药IND,获国家药品监督管理局药品审评中心(NMPA)批准,下面小编帮大家简单汇总一下,以供参考(详见下表)。
小编寄语
间充质干细胞的临床安全性良好,而且具有多向分化潜能、免疫调节及自我更新能力,加之来源丰富,临床应用较多的包括脐带间充质干细胞、牙髓间充质干细胞、脂肪间充质干细胞等诸多类型,在慢病防治、美容抗衰等领域中,具有不可替代的优势。
值得欣慰的是,近年来我国干细胞临床转化呈现蓬勃发展的态势,新药IND逐年上升,涵盖的病种更加广泛,小编也希望随着干细胞产品研发规模的不断扩大,我们的再生医疗技术能早日追平美日等干细胞强国,以造福更多的患者!
参考资料
[1]Maldonado,et al.Clinical utility of mesenchymal stem/stromal cells in regenerative medicine and cellular therapy.J Biol Eng 17,44(2023).
https://jbioleng.biomedcentral.com/articles/10.1186/s13036-023-00361-9#citeas
[2]https://www.cde.org.cn/main/xxgk/listpage/4b5255eb0a84820cef4ca3e8b6bbe20c