
2006年,山中伸弥通过将Oct3/4、Sox2、c-Myc和KLF4引入体细胞,成功制备了胚胎干细胞样细胞。根据这些细胞的多能性,他将其命名为“诱导多能干细胞”(iPSC)。事实上,iPSC 通过在不同的培养条件下生长可以分化成不同的细胞类型。iPSC 已被证明具有巨大的前景,包括解决使用胚胎干细胞的伦理和安全问题的能力。iPSC 用于多种科学领域,例如疾病建模和药物发现、发育生物学和再生医学。CRISPR-Cas9 技术的采用能够快速、准确地对 iPSC 进行基因编辑,加速并改进了这些应用。
基于 CRISPR-iPSC 的疾病建模消除了为传统疾病建模应用获取患病组织样本的主要障碍(将患者暴露于危险的活检)。iPSC 可以用生长因子和培养条件的理想组合进行处理,以分化成指定的细胞类型。通过这种方法,基于 CRISPR 的技术可以加速神经退行性疾病的发展,该技术使用 iPSC 来模拟导致神经退行性疾病发展的整个突变基因库。因此,基于 iPSC 的基因组编辑疾病模型可用于生成疾病病理生理学及其潜在药物靶点的有用信息,从而为寻找新的治疗方法打开了大门。神经退行性疾病 例如阿尔茨海默病、帕金森病、亨廷顿舞蹈症和肌萎缩侧索硬化症。
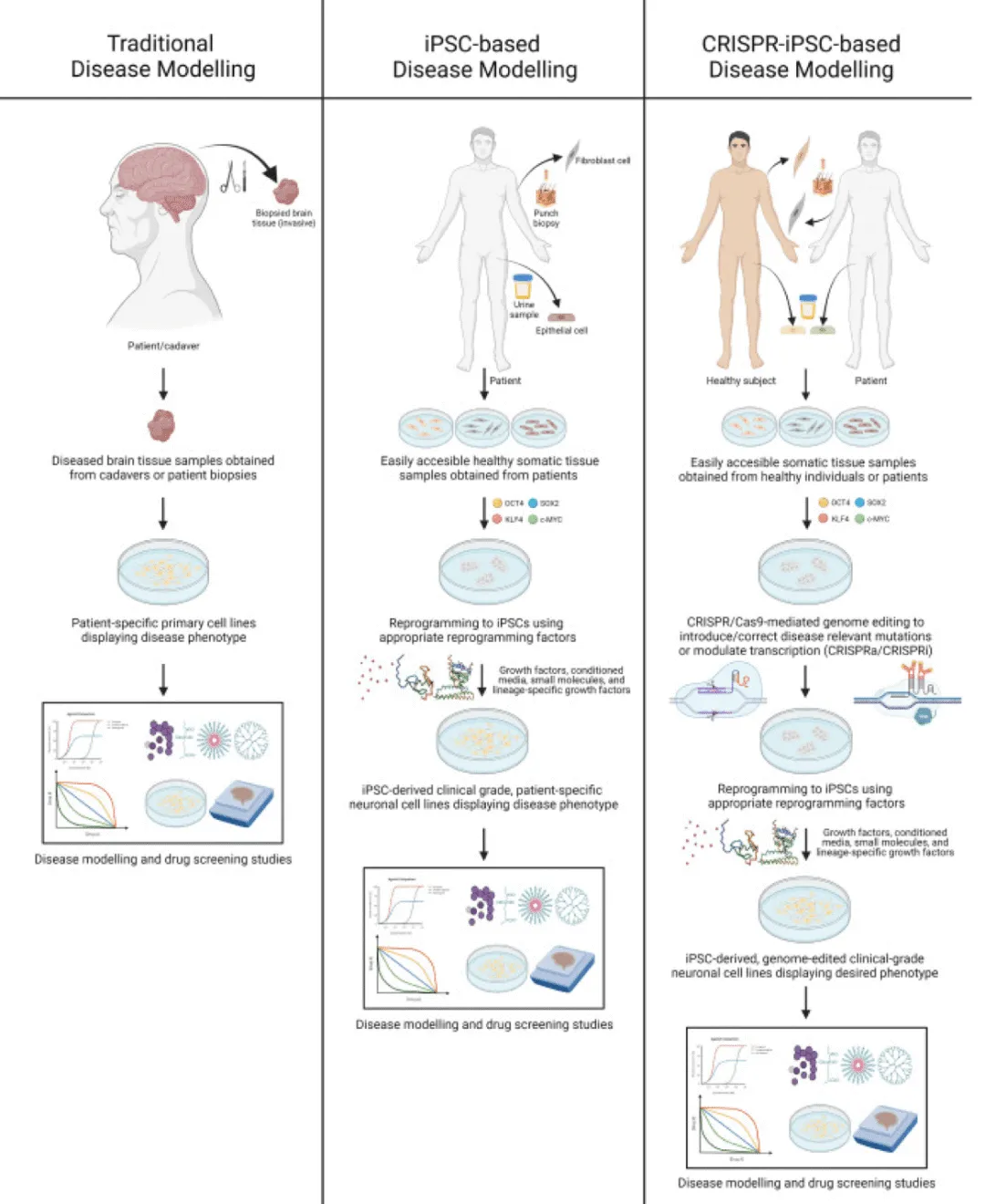
基于 CRISPR-iPSC 的疾病建模
CRISPR-Cas9系统具有改变发育生物学的潜力 通过让研究人员能够以无与伦比的洞察力来检查许多动物的基因组活动与细胞分裂、增殖和形态发生等发育过程之间的相互作用。此外,iPSC 中的 CRISPR 筛选也已用于研究神经发育和退行性疾病、细胞命运规范以及特定细胞谱系的生存机制。例如,单细胞 CRISPR 筛选已成功用于识别 iPSC 产生的人类神经类器官大脑发育过程中的细胞命运调节因子。
iPSC 在该领域引入了创新发展再生医学通过提供潜在的独特治疗选择来恢复受损组织。iPSC和CRISPR-Cas9技术与组织工程技术的结合有可能显着扩展再生研究领域。例如,CRISPR-Cas9 可用于纠正与多种疾病相关的单一遗传异常,包括 HCM 和 DCM。然后使用 iPSC 创建校正后的基因突变细胞系。最后但并非最不重要的一点是,可以使用组织工程技术从iPSC中创建健康组织,然后移植到患者体内。