
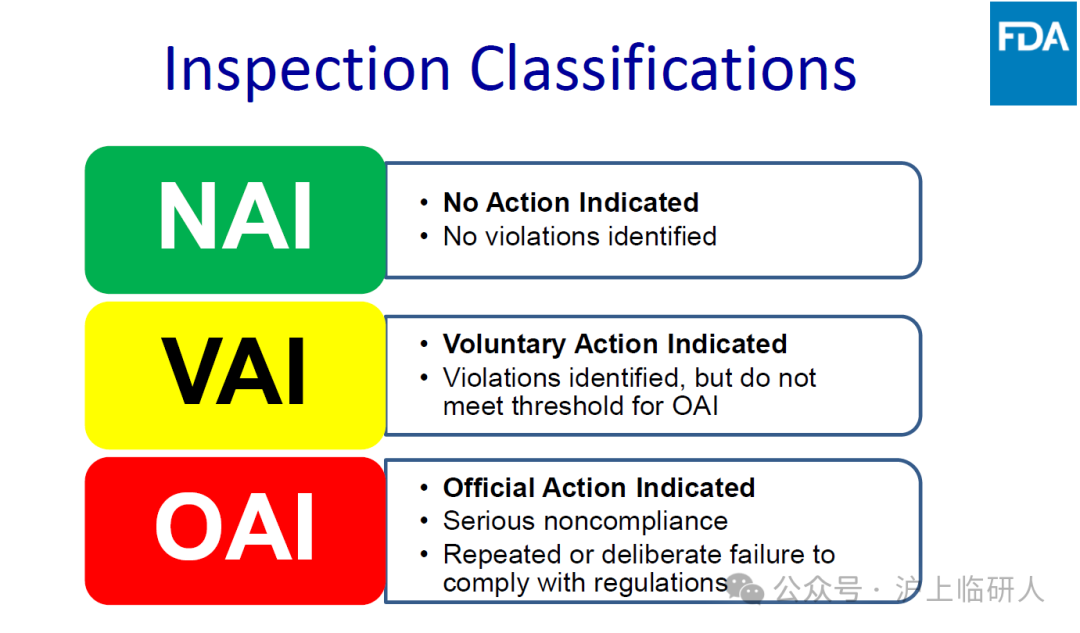
美国临床试验现场核查的结论分为:
NAI:“不需要采取行政措施”
VAI:“发现问题,自愿采取行政措施”
OAI:“严重问题,需要采取官方行政措施”
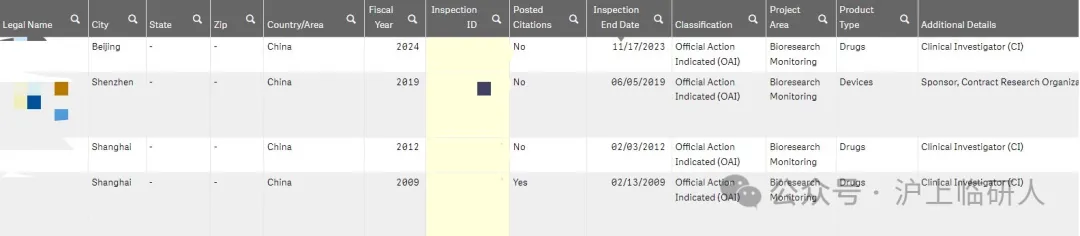
自2009年至2024年8月,我国接受FDA核查后,结论为“严重问题,需要采取官方行政措施”的共4次,发生时间分别是2009年、2012年、2019年和2024年,前两次是在“722”之前,2019年的核查是针对申办方的,所以2024年这次是“722”事件后,FDA现场核查中国临床试验机构首次出现“OAI”。
国家癌症中心李宁教授在去年的临床研究大查房中阐述了三个观点:
中国临床试验质量达到世界领先水平;
中国临床研究质量监管体系达到世界领先水平;
中国临床研究的速度和评价体系达到世界领先水平。
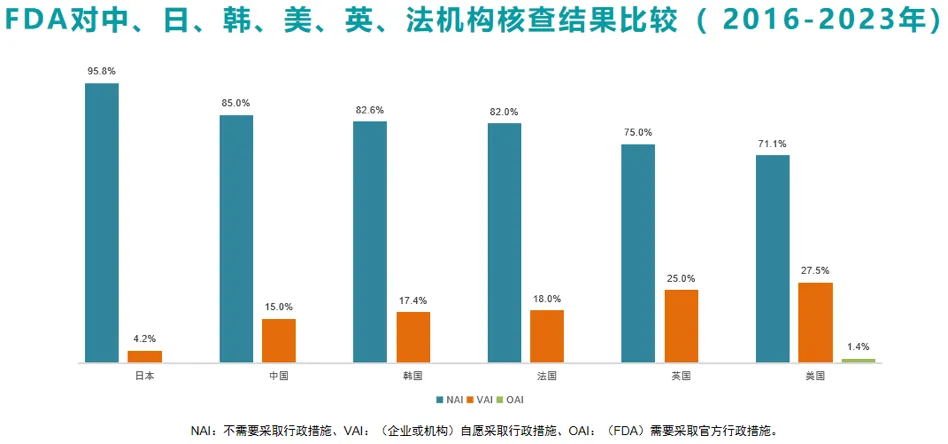
李宁教授整理并比较了2016~2023年FDA在日本、中国、韩国、法国、英国和美国临床研究机构现场核查的结果,展示如下。中国机构的研究质量超过韩国、法国、英国和美国等发达国家,仅次于日本。并且,在中国临床试验机构现场核查的过程中,FDA没有发现任何一次“严重问题,需要采取官方行政措施”。
问:中国临床试验的质量真的过关吗??
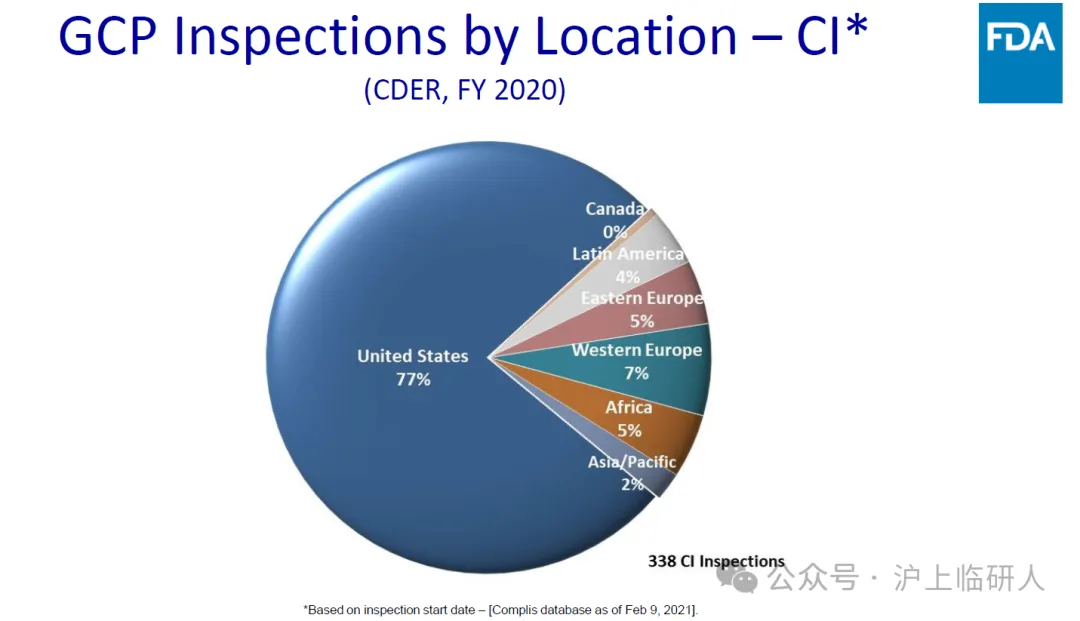
我们认为未必。FDA临床试验现场核查的数量在美国本土超过任何海外其他地方的十倍以上,自2009年至今,我国临床试验机构接受FDA核查总共才62次,跟日韩相当,FDA对英法的临床试验现场核查数量大概是我国的两倍左右,这样大家就比较好理解为什么2023年前FDA对以上列举的海外的临床试验机构现场核查没发现“OAI”。做临床试验大家都对样本量很敏感,这个样本量显然是比较低的。
本次“OAI”是“722”事件后FDA现场核查中国临床试验机构首次出现的,2015年“722”事件后,在中国监管和全体行业共同努力下,中国临床试验质量确实是取得了飞速进步。但是我们不能盲目乐观,我国目前的临床试验质量并不乐观,尚需努力!