
基因疗法作为一种新兴的医疗技术,特别是在治疗难治性疾病方面展现出了巨大的潜力和发展势头。2024年上半年,全球有三款基因疗法获得了美国食品药品监督管理局(FDA)的批准上市。我国的基因疗法研发也取得了突破性进展,多款获批进入临床试验阶段。本文梳理了2024年第三季度我国7款基因疗法的新药临床试验申请(IND)获批进展(备注,本文描述的基因治疗不包含CAR-T等免疫细胞疗法、小核酸药物、干细胞与再生疗法)。
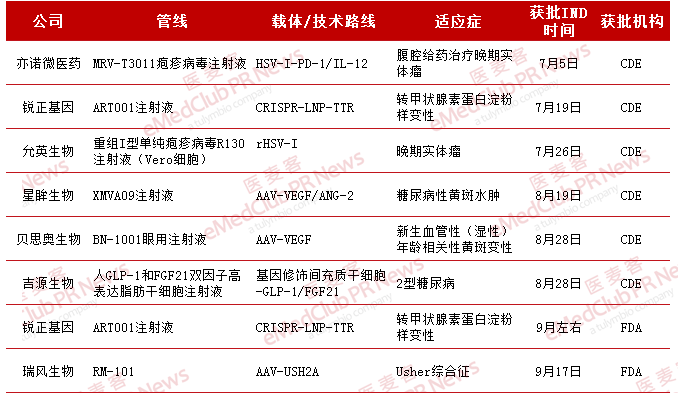
▲2024年Q3基因治疗药物获批IND进展
如上表所示,今年第3季度我国共有7款(以管线名计)基因疗法管线获批IND,此次获批数量大致与2023年度下半年IND获批总数持平。据不完全统计,2024年上半年有十多款基因疗法获批IND。这表明我国基因疗法的开发势头强劲。其中锐正基因的ART001注射液先后获得药品审评中心(CED)和美国FDA的两项临床默示许可。
从该领域的细分角度审视,我国基因疗法也呈现出多点突破、稳中有进的趋势。CRISPR编辑技术极大地提升了基因编辑的精确性和效率,为基因疗法开辟了新的路径。传统的单纯疱疹病毒(HSV)和腺病毒相关病毒(AAV)的病毒载体类型之外,开发出了具有更高效、更安全、更稳定且精确组织靶向特性的新一代脂质纳米颗粒(LNP)。此外,还有利用间充质干细胞的归巢特性,实现基因治疗和干细胞的结合,起到基因干预和组织修复双重作用。在适应症方面,基因疗法的开发方向不仅集中在罕见病和实体瘤的治疗上,还拓展到了2型糖尿病(T2DM)等领域。
溶瘤病毒实现“以毒攻毒”和免疫调节双重治疗
1、MVR-T3011
7月5日,亦诺微医药1类创新型生物制品MVR-T3011疱疹病毒注射液获CDE临床试验默示许可,用于腹腔给药治疗晚期实体瘤。
MVR-T3011是亦诺微医药拥有自主知识产权的三合一疱疹溶瘤病毒创新产品,其基于对野生HSV-I型疱疹病毒骨架的全新设计,确保病毒在肿瘤细胞内拥有强劲的复制能力的同时,在正常细胞内复制能力得到抑制,实现最优减毒效果。此外,MVR-T3011携带了两个最新且被充分验证过的外源性免疫调节基因PD-1抗体和IL-12,以促进肿瘤微环境的免疫反应。使其在裂解肿瘤细胞的同时,从而发挥肿瘤的溶瘤与免疫的双重治疗。
MVR-T3011在最新的1期临床数据显示,给予高危卡介苗(BCG)失败的非肌层浸润性膀胱癌(NMIBC)患者RP2D剂量的MVR-T3011后,3个月CR率达81.8%(9/11)。在9名达到6个月评估的患者中,有8名维持了CR,且其中4名达到9个月评估的患者全部处于CR状态。并且展示出良好的安全性。
2、R130
7月26日,允英生物自主研发的第三代重组溶瘤病毒“重组I型单纯疱疹病毒R130注射液(Vero细胞)”获得国家药品监督管理局核准签发《药物临床试验批准通知书》,适应症为晚期实体瘤。
该疗法可发挥“溶瘤病毒杀伤”+“免疫系统激活”的双重作用,通过R130携带的“三通路”激活免疫系统,逆转耗竭性T细胞,使其重新焕发活力。
在由研究者发起的临床研究项目(IIT)阶段,R130展现出优异的临床疗效与安全性,且未观察到严重不良反应事件。
中国首个获FDA临床试验许可的基于非病毒载体的体内基因编辑疗法
7月22日,锐正基因宣布其“ART001注射液”已于7月19日获CDE临床试验默示许可,用于治疗转甲状腺素蛋白淀粉样变性(ATTR)。9月2日,锐正基因宣布ART001近期获得了美国FDA临床试验许可,成为我国第一个获美国FDA临床试验许可的基于非病毒载体的体内基因编辑候选药物。
ATTR是一种致死性罕见疾病,由转甲状腺素蛋白(TTR)四聚体不稳定形成的淀粉样纤维沉积于人体多器官所致。
ART001是一种在研的体内基因编辑疗法,以脂质纳米颗粒(LNP)作为递送载体,将靶向TTR基因的基因编辑组件递送至肝脏,安全特异地编辑TTR基因,阻断TTR蛋白的表达,从根源上避免产生淀粉样物质异常沉积。此外,该疗法的体内基因技术平台以LNP作为递送载体,不需使用病毒和细胞,有望大幅度降低新药研发生产成本。
ART001目前正在中国开展临床1期试验。IIT研究显示,所有受试者均已完成至少24周随访,给药后4周TTR蛋白较基线即可下降90%以上,24周后保持稳定。
国内首个使用基因修饰间充质干细胞治疗2型糖尿病疗法
8月28日,吉源生物提交的“人GLP-1和FGF21双因子高表达脂肪干细胞注射液”IND获CDE临床默示许可,适应症为2型糖尿病(T2DM)。这是国内首次使用基因修饰间充质干细胞治疗T2DM的临床试验申请,有望为糖尿病患者带来新希望。
人GLP-1和FGF21双因子高表达脂肪干细胞注射液是吉源生物自主研发的冷冻保存型干细胞制剂,源自患者腹部脂肪,利用企业具有的干细胞技术平台和基因修饰技术平台,将GLP-1和FGF21两个代谢病治疗药物装到干细胞药物中,临床用于治疗难治型T2DM。该疗法赋予了普通间充质干细胞新的靶点和功能,不但能实现GLP-1和FGF21对糖脂代谢的调控作用,同时还可利用其归巢特性实现靶向局部治疗,起到保护胰岛β细胞和抑制并发症的效果,在矫正T2DM代谢紊乱和修复组织器官等方面取得了突破。
基于AAV载体的基因疗法多领域大放异彩
1、XMVA09
8月19日,星眸生物自主研发的基因治疗I类创新药“XMVA09注射液”的第2项新IND申请已获得CDE批准,此次新批准的适应症为糖尿病性黄斑水肿(DME)。今年3月,XMVA09注射液针对湿性年龄相关性黄斑变性(wAMD)适应症的IND申请获得CDE临床默示许可。
XMVA09注射液是首个兼具实现双特异性靶点与玻璃体腔内注射衣壳的基因治疗候选药物。其采用全新的AAV衣壳,通过玻璃体腔内注射即可感染到紧贴脉络膜病灶的视网膜色素上皮层(RPE)细胞,为后续临床应用提供了更便捷的途径。此外,XMVA09注射液采用双抗设计,同时靶向血管内皮生长因子(VEGF)和血管生成素-2(ANG-2)双靶点,提高了药物的治疗效果,增加了对于VEGF不敏感患者的覆盖范围。
2、BN-1001
8月28日,贝思奥生物自主研发的基因治疗I类创新药“BN-1001眼用注射液”IND申请正式获得CDE默示许可,用于治疗新生血管性wAMD。
BN-1001眼用注射液采用了AAV基因治疗策略,是目前国内外已披露的同类产品中剂量最低且能持续稳定表达抗VEGF分子的产品。该注射液能在患者中最大程度地降低症状的发生率,有望实现“一次治疗,终生治愈”的目标,满足当前日益增加的临床需求。
3、RM-101
9月17日,美国FDA正式批准了瑞风生物针对Usher综合症的创新药物RM-101的IND申请。这一批准标志着Usher综合征全球首个基于AAV的基因编辑候选药物研发取得了里程碑式的突破与进展。
RM-101是瑞风生物开发的针对Usher综合征USH2A基因相关视网膜色素变性的创新基因疗法,是基于AAV的基因编辑类候选药物,能特异性靶向USH2A RNA,调控可变剪接生物学过程,诱导功能正常蛋白的表达恢复。RM-101通过视网膜下注射给药,有望实现一次性给药并长期有效。
前期实验结果表明,在小鼠模型中注射RM-101可诱导高达90%的USH2A外显子13跳跃,效果持久稳定,且对视网膜无影响。同时,在非人灵长类视网膜下腔注射RM-101可介导更高水平的靶外显子跳跃,效果稳定且观察期内眼部无异常。
总结
综上 ,我国在基因疗法技术上取得了重大突破,有望为严重疾病患者提供可及性和治愈性药物。在基因编辑技术和新型载体的开发上具备了高水平的技术积累,并持续在实体瘤和眼科等疾病领域积累了开创性成果,并拥有体内和体外两大创新药方向。随着政策支持和国际合作的不断加深,中国自主研发的基因疗法进入“转化快车道”,将造福于全球患者。