
2024 年底中美两款干细胞的上市获批点燃了干细胞再生医学赛道的热度,成为 2025 年的热门话题,在资本依旧寒冬的上半年逆势上扬,近十家企业累计完成超 5 亿元人民币融资,多个临床管线取得关键进展,海南博鳌的先行收费项目推进了干细胞治疗行业的发展。上篇文章梳理了干细胞再生医学赛道基本脉络,本文对国内在研管线进行综合盘点,供参考与讨论。
一、在研管线梳理,适应症进展差异大
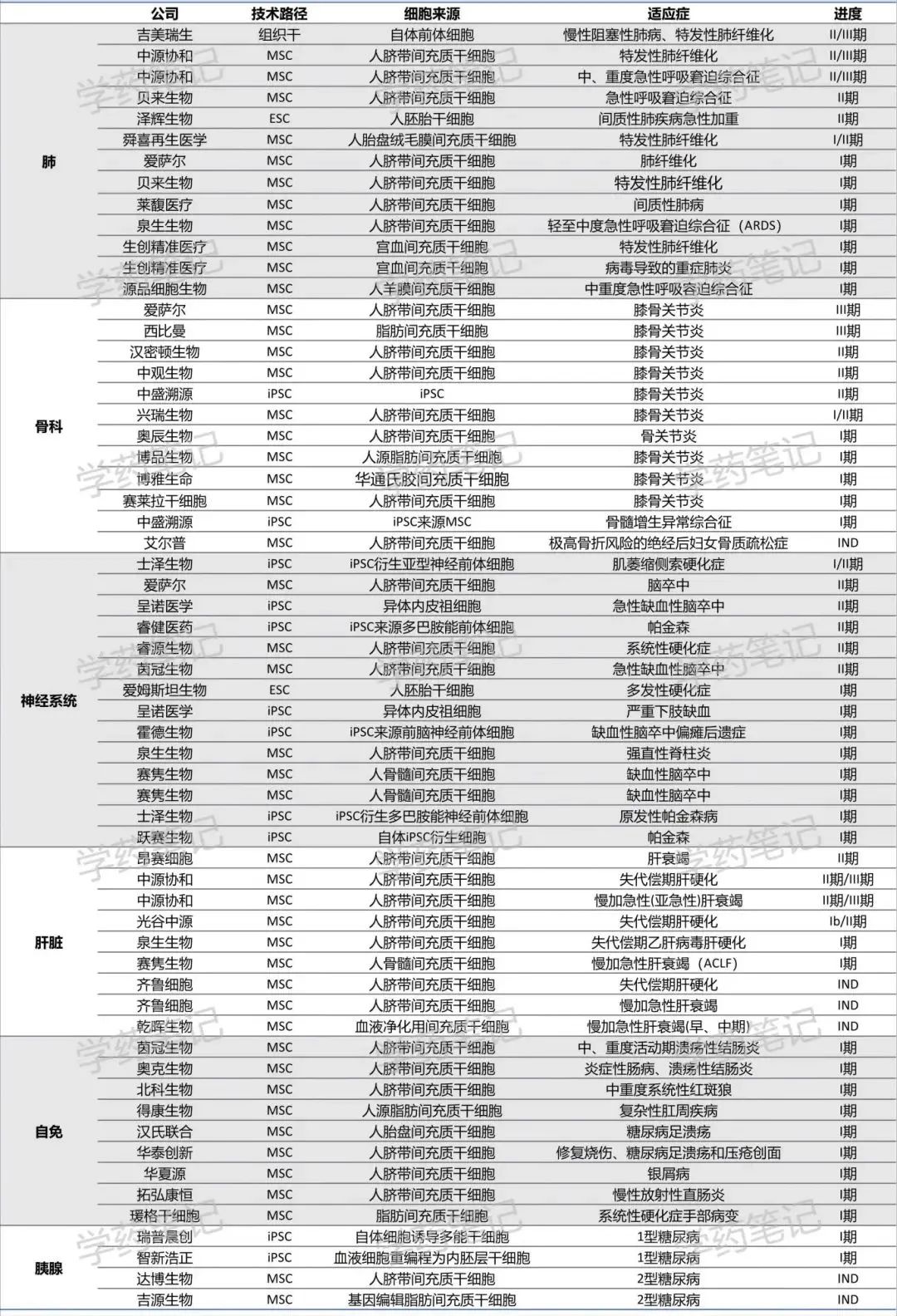
干细胞再生医学方面根据公开信息统计的 133 条在研管线中,从适应症类型的角来看,神经系统例如脑卒中与帕金森症相关的管线数量高达 24 条,其中以 iPSC 路径的管线占据一半以上,呼吸系统适应症达 23 条在研管线,膝骨关节炎适应症目前超 13 条管线在研,肝、皮肤、GvHD 等系统性疾病各有 11 条管线在研,这其中 MSC 均为主要技术路径。按进度来看,目前中国首款上市的干细胞治疗药物来自铂生卓越的人脐带间充质干细胞治疗 GvHD,另外多个 GvHD 管线位于 III 期或 II 期临床试验。除此之外进入临床 3 期的管线包含 2 条膝骨关节炎适应症药物以及 2 条肛周疾病治疗药物。
从细胞类型角度,间充质干细胞技术路径管线超 80 条,进展相对较快,中国首款上市的干细胞治疗药物来自铂生卓越的人脐带间充质干细胞治疗 GvHD,另外多个管线位于 III 期或 II 期临床试验。iPSC 管线数量为 35 条,管线进展相对早期,仅有少数管线位于临床 I 期与 II 期,大多数管线位于临床前或 IND 申请阶段。组织干细胞管线数量为 7 条,其中代表性的吉美瑞生的肺气管基底层干细胞治疗特发性肺纤维化位于临床 II/III 期,其余均位于临床前或 IND 申请阶段。胚胎干细胞方面主要为泽辉生物港股申请上市与爱姆斯坦生物。

截至 2025 年 5 月部分干细胞再生医学管线情况如下:
二、干细胞特征对应不同应用场景
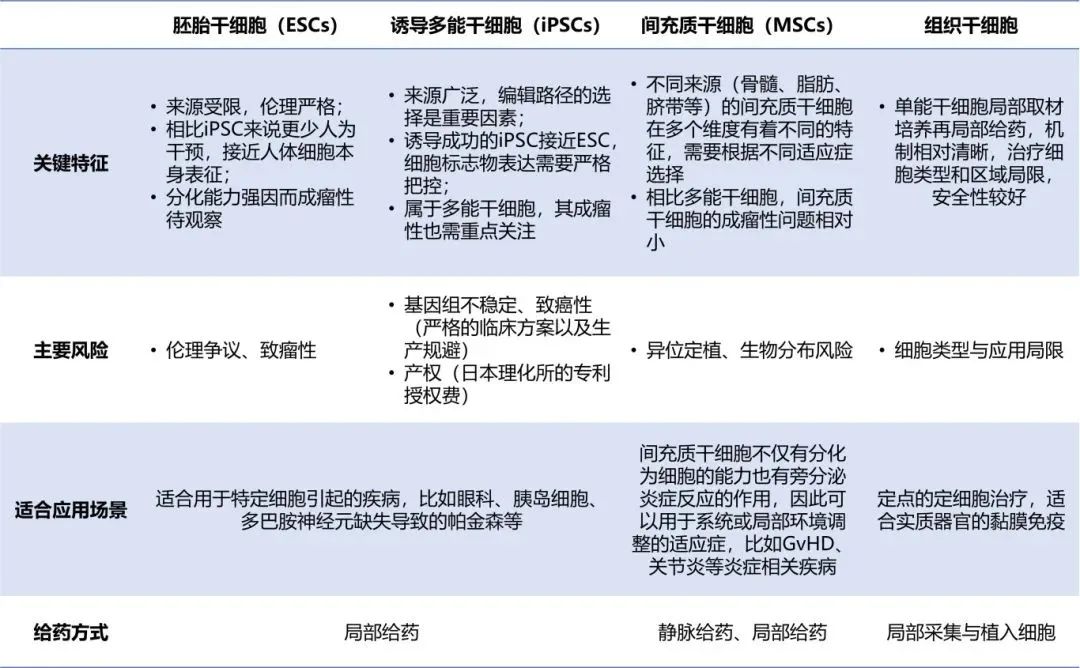
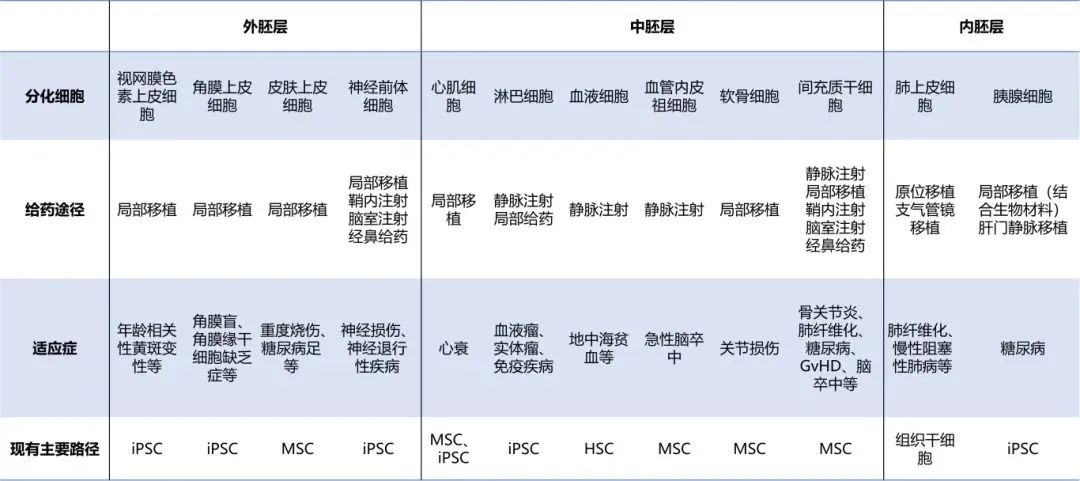
1. 胚胎干细胞
(1)关键特征
胚胎干细胞来源于早期胚胎,相比逆分化诱导生成的 iPSC 来说人为干预更少,因此更接近人体细胞本身表征。然而胚胎干细胞的来源受限,因其获取需要严格符合伦理要求的胚胎捐献,因此用于药物开发的细胞库均来自国内符合伦理要求的机构,目前国家干细胞资源库是中国大陆唯一提供包含伦理资料的临床级人胚干细胞。
(2)适合应用场景
适合用于特定细胞引起的疾病,据统计国外眼科适应症占据近半。眼睛独特的免疫特权,加上血眼屏障的加强,大大降低了移植细胞的排斥风险,且眼睛独特而孤立的结构最大限度地减少了这些细胞向身体其他部位的扩散,从而降低了意外的全身性影响的可能性,因此较为适合胚胎干细胞疗法。
(3)突破方向
安全性问题是最引人瞩目的问题,如何保证细胞移植后不引起肿瘤形成、畸胎瘤等并发症是当前研究的重要课题。另外,胚胎干细胞的定向诱导分化仍存在挑战,不同的细胞系发育潜力不同。胚胎干细胞的多能性来源于其独特的基因表达调控机制,目前对这一机制的了解仍不充分。
2. 诱导多能干细胞
(1)关键特征
诱导多能干细胞由人类体细胞重编程逆分化培养而成,因此其来源广泛,公司自建 iPSC 细胞库或从服务方购买均可。诱导成功的 iPSC 的标准是接近胚胎干细胞,因此细胞表征需要严格把控。另外,由于日本理化所对 iPSC 相关有着较为完整的专利保护,因此专利费支付是中国 iPSC 企业难以绕开的话题。
(2)适合应用场景
适合用于特定细胞引起的疾病,比如眼科、胰岛细胞、多巴胺神经元缺失导致的帕金森等。
(3)突破方向
1)iPSC 重编程问题:iPSC 由于需要多步诱导体外重编程,除了需要注意重编程方式的是否整合以及表达效率与时间,也需要注意重编程后的细胞如何建立更为科学的细胞表征方式。iPSC 细胞诱导后仍旧可能携带原始细胞的表观遗传修饰,基因编辑可能带来诸多风险,其细胞质量需要多加留意。
2)排斥问题:对于 iPSC 和 MSC 细胞选择需要找到免疫适配度更高的细胞类型,在 iPSC 和 MSC 的应用项目中多使用异体细胞,可以选择挑选万能供体细胞或敲除免疫原性基因,在此基础上临床可选择搭配免疫抑制剂。
3)分化效率:iPSC 需要多步诱导重编程,为了较快分化减少人为干预的影响,以及更接近高活性的胚胎干细胞,其分化效率尤为关键。
3. 间充质干细胞
(1)关键特征
间充质干细胞是最先成药的类型,其不仅有分化的功能也发挥旁分泌调节炎症反应的作用,市面上脐带、骨髓、脂肪等来源的间充质干细胞库较多,是研究最为广泛的细胞类型。
(2)适合应用场景
可用于系统或局部环境调整的适应症,比如 GvHD、关节炎等炎症相关疾病。
(3)突破方向
1)成瘤性仍待观察:尽管大量研究和临床试验普遍报告间充质干细胞治疗是安全的,副作用最小,但肿瘤发生的可能性仍然是一个重大问题。这是因为间充质干细胞与肿瘤细胞具有某些共同特征,例如长时间的增殖和对细胞凋亡的高抵抗力。包括供体年龄和受体免疫状态在内的多种因素会影响间充质干细胞移植后肿瘤发生的风险。MSC 的操作和长时间培养也可能导致遗传不稳定,增加恶性转化的可能性。
2)药代动力学与疗效机制不明确:MSCs 在体内的动态分布、迁移效率及长期存活率仍不清晰,影响剂量标准化。研究表明,大多数静脉注射的 MSCs 驻留在肺部,如何使 MSCs 归巢到损伤部位发挥作用十分重要。
3)干细胞异质性导致疗效差异:同一干细胞群体中存在基因表达、蛋白质表达、表观遗传修饰、细胞形态、代谢途径等方面的生物学差异。虽然通过单细胞 RNA 测序等技术可识别出多个功能亚群,并分析每个亚群的主要功能差异,但仍需解决将所需功能亚群细胞分选的技术难点和特殊培养基的定制难度。攻克这些难度,才可以大大提高治疗的一致性,加强治疗效果。
4)生产标准化难题:不同来源、不同培养条件、冻存技术均会导致 MSCs 的异质性,从而导致疗效波动。2024 年全球仅 2 款 MSC 产品获批,也凸显了标准化生产和质量控制的重要性。每种干细胞 MSCs 产品需严格控制生产流程,统一标准以减少可能的疗效差异。
毫无疑问,再生医学将是 21 世纪医学界发展的重要方向之一,虽然对比其他疗法整体还是处于早期阶段,除了肺、关节、神经系统等少数几个方向研究时间较长外,其他领域存在大量空白,市场可期。