
来源:BioArt
哺乳动物中成体神经干细胞 (neural stem cells, NSCs) 可以通过增殖、分化和迁移一系列过程源源不断地产生新生神经元,这一过程被称为成体神经发生。成体神经发生产生的新生神经元在学习记忆和情绪调节等方面发挥重要功能,而它们的功能异常通常与大脑各种疾病相关【1】。成体NSCs并不是均质的,而是在细胞形态、增殖能力、细胞潜能和功能上呈现出高度的异质性【2-4】。然而,目前并不清楚成体NSCs的异质性是什么时候建立的,以及神经源性生态位中成体NSCs不同亚群在自我更新和分化能力方面有何不同【5】。因此,解释成体NSCs不同亚群的起源和对神经发生的贡献,是促进我们对成体NSCs和成体神经发生过程理解的一个充满挑战却又十分关键步骤。
在胚胎神经发育时期,形态发生因子Wnt (wingless/integrated) 和Shh (sonic hedgehog) 呈浓度梯度分布,从而决定大脑背腹轴的发育。而且,研究表明侧脑室下区 (subventricular zone, SVZ) 中成体NSC的区域特异性是由在胚胎发育早期通过形态发生因子和转录因子串联调控下决定的。Wnt和Shh在空间和时间上的特定浓度梯度对胚胎和成年大脑的模式化起着重要作用,但它们是否决定了不同成体NSCs亚群的起源仍然未知。
2023年8月21日,来自中国科学院遗传与发育生物研究所的郭伟翔课题组在Developmental Cell期刊在线发表了题为 Functional Heterogeneity of Wnt-Responsive and Hedgehog-Responsive Neural Stem Cells in the Murine Adult Hippocampus 的研究论文。该文章不仅揭示了成体NSCs的异质性多重起源,而且提出了不同的成体NSCs亚群存在功能异质性的概念。

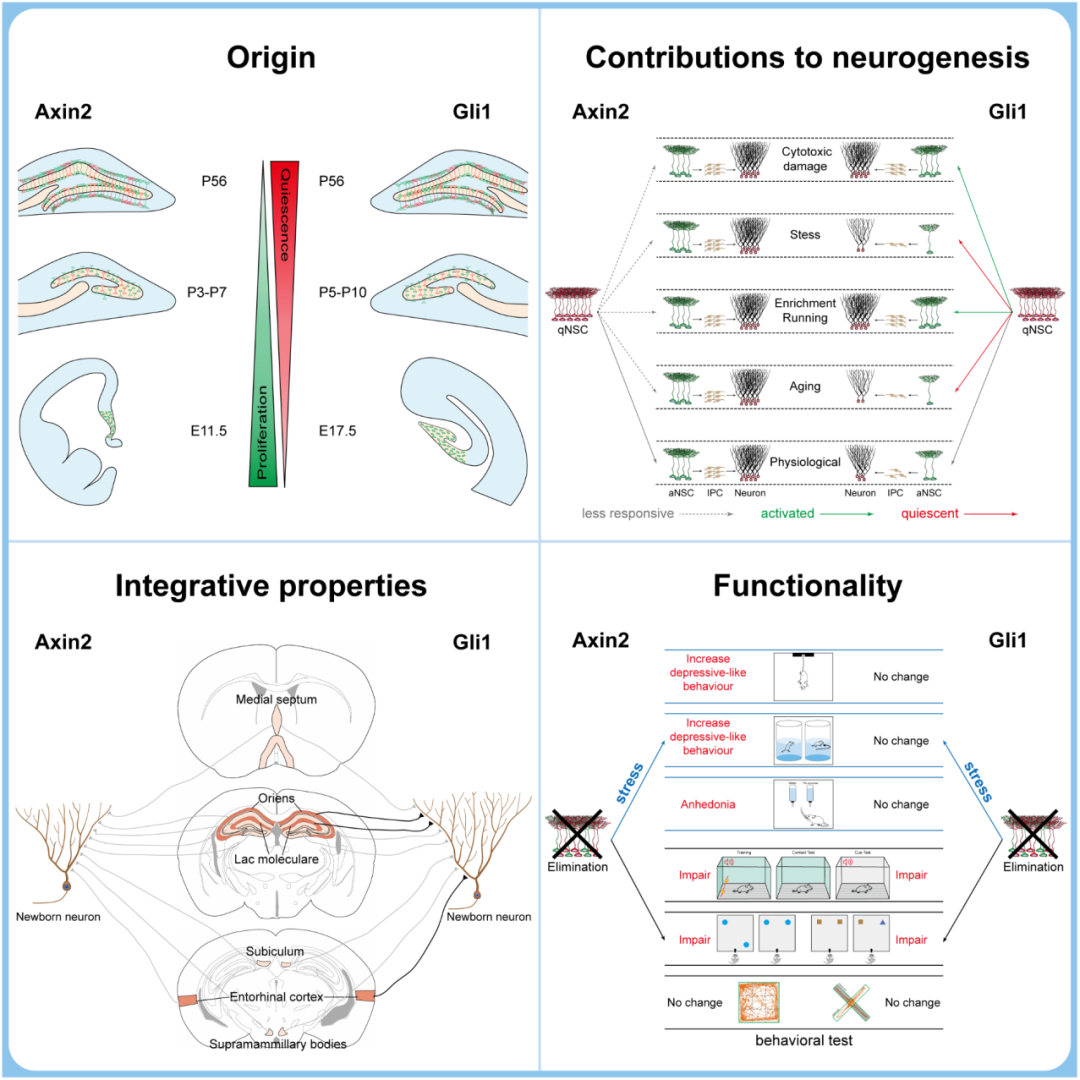
文章作者使用Axin2-CreERT2或Gli1-CreERT2小鼠分别对海马体中Wnt响应(Axin2+)和Shh响应 (Gli1+) 的两个不同NSCs亚群进追踪和分析,发现xin2+和Gli1+胚胎神经祖细分别在胚胎发育早期和晚期贡献海马体中的成体NSCs。相对于Gli1+ NSCs,Axin2+ NSCs在出生后更早地定位于海马体的颗粒下层 (subgranular zone) 。进一步的研究发现,Axin2+胚胎NSCs在生后P3-P5转化为更静止的成体NSCs,而Gli1+胚胎NSCs在出生后P5-P7转化为更静止的成体NSCs。这些结果说明了成体海马中Axin2+ 和Gli1+ NSCs时空起源的不同。
为了探索Axin2+和Gli1+ NSCs在成体海马神经发生中的贡献是否存在差异,作者开展体内细胞克隆分析。发现成体海马中Axin2+ NSCs具有更高的增殖活性和积极的自我更新能力,而Gli1+ NSCs相对静止。同时Axin2+ NSCs对环境刺激不敏感且在衰老过程保持相对稳定的增殖活性,而Gli1+ NSCs对环境刺激有显著的响应,并随着衰老的进程逐渐静止。这表明成体海马中Axin2+和Gli1+ NSCs对成体神经发生贡献的不同。
为了寻潜在的分子与细胞证据解释Axin2+和Gli1+ NSCs在成体海马神经发生的差异, 作者开展scRNA-seq分析。他们发现Axin2+和Gli1+ NSCs在海马成体神经发生过程中遵循不同的神经发生轨迹。进一步对新生神经元的形态进行分析, 发现Gli1+ NSCs产生的新生神经元比Axin2+ NSCs产生的新生神经元具有更复杂的树突分枝。更为重要的是,通过逆行病毒示踪,发现Gli1+ NSCs产生的新生神经元比Axin2+ NSCs产生的新生神经元表现出更高的突触连接率,接收更多来自大脑中不同的特定脑区的神经元突触输入,例如内侧隔核和内嗅皮层。这些结果说明Axin2+和Gli1+ NSCs分化产生的神经元存在着一定功能异质性。
为了探究成体Axin2+和Gli1+ NSCs是否参与了海马体的不同功能,作者使floxed-stop可操控表达的细胞毒素-白喉毒素A亚基 (diphtheria toxin subunit A),特异性清除Axin2+和Gli1+ NSCs。通过行为学分析发现,特异性清除Axin2+和Gli1+ NSCs都会导致海马依赖性学习和记忆功能受损,这表明Axin2+和Gli1+ NSCs是学习和记忆功能所必需的。意想不到的是,只在特异性清除Axin2+ NSCs时,小鼠在束缚压力应激下更易获得抑郁样行为。这说明了Axin2+ NSCs,而不是Gli1+ NSCs,直接参与缓冲压力应激反应。
综上所述,通过对以上两群不同海马成体NSCs从胚胎起源、细胞增殖分化以及对海马功能的全面性研究,该研究不仅揭示了成体NSC异质性的多重起源,而且进一步拓展了成体NSC异质性的概念:不同成体NSC亚群可能具有不同功能而且产生的神经元也具有异质性。
中国科学院遗传发育所郭伟翔研究组博士罗行为本文的第一作者,郭伟翔研究员为本文的通讯作者。中国科学院遗传发育所王秀杰研究员和戴敏博士等参与了该研究。
原文链接:https://10.1016/j.devcel.2023.07.021
参考文献:
1.Ming, G. L. & Song, H. Adult neurogenesis in the mammalian brain: significant answers and significant questions. Neuron 70, 687-702 (2011). https://doi.org:10.1016/j.neuron.2011.05.001
2.Bonaguidi, M. A. et al. Diversity of Neural Precursors in the Adult Mammalian Brain. Cold Spring Harb Perspect Biol 8, a018838 (2016). https://doi.org:10.1101/cshperspect.a018838
3.Goodell, M. A., Nguyen, H. & Shroyer, N. Somatic stem cell heterogeneity: diversity in the blood, skin and intestinal stem cell compartments. Nat Rev Mol Cell Bio 16, 299-309 (2015). https://doi.org:10.1038/nrm3980
4.Donati, G. & Watt, F. M. Stem cell heterogeneity and plasticity in epithelia. Cell Stem Cell 16, 465-476 (2015). https://doi.org:10.1016/j.stem.2015.04.014
5.Berg, D. A., Bond, A. M., Ming, G. L. & Song, H. Radial glial cells in the adult dentate gyrus: what are they and where do they come from? F1000Res 7, 277 (2018). https://doi.org:10.12688/f1000research.12684.1