
来源:Cell Regen编辑部
人类多能干细胞(human pluripotent stem cells, hPSCs)包括胚胎干细胞(ESCs)和诱导多能干细胞(iPSCs),具有分化出多种细胞组织的潜能,是体外生产血细胞的重要来源之一。随着对造血机制了解的深入,由hPSCs生成造血祖细胞、前体细胞的效率也随之增高。然而,通过hPSCs大规模生产出有功能的成熟血细胞并应用于临床仍有难度。
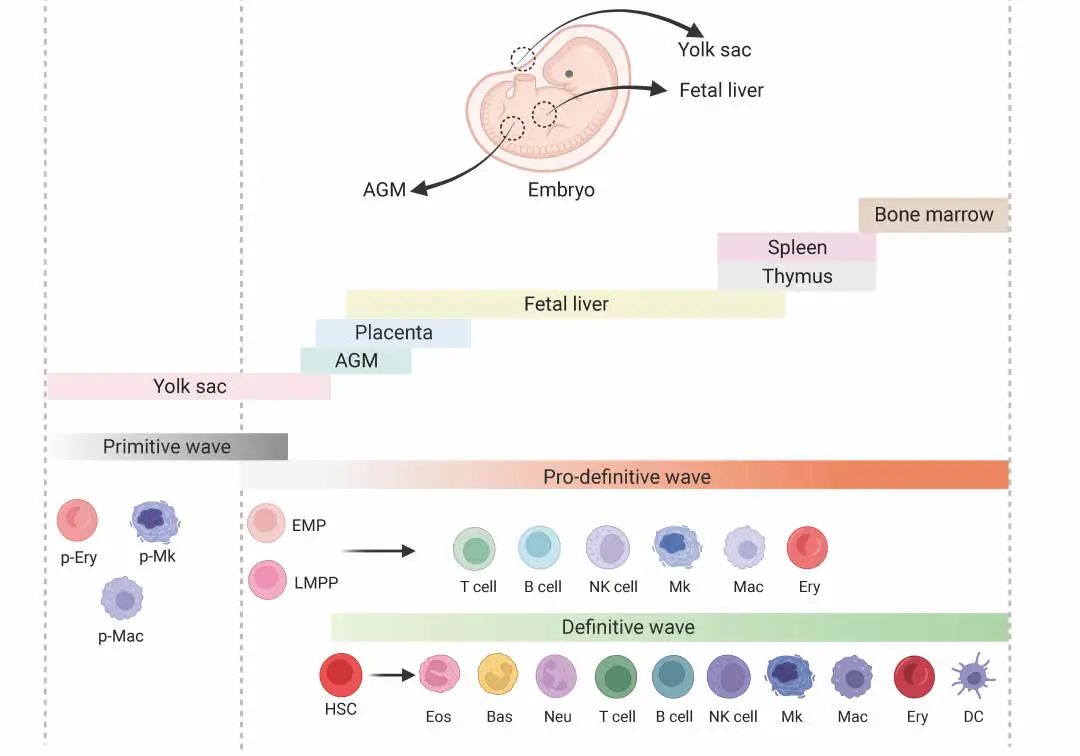
体内胚胎造血示意图
近日,浙江大学黄河/钱鹏旭课题组在Cell Regeneration上发表了题为“Generating hematopoietic cells from human pluripotent stem cells: approaches, progress and challenges”的综述文章,较为全面地总结并比较近年来从hPSCs中生产造血干/祖细胞(hematopoietic stem/progenitor cells, HSPCs)和成熟血细胞的各种最新方法。此外,文章也探讨了生产临床级别血细胞的主要挑战及可能的解决方法。

在临床上,造血干细胞和终末分化血细胞总是供不应求。hPSCs衍生的HSPCs和成熟血细胞在移植、免疫治疗、输血等治疗上具有巨大潜力。文章详细总结了从hPSCs衍生HSPCs、淋巴细胞、巨核细胞/血小板、红细胞、巨噬细胞、粒细胞的方法。
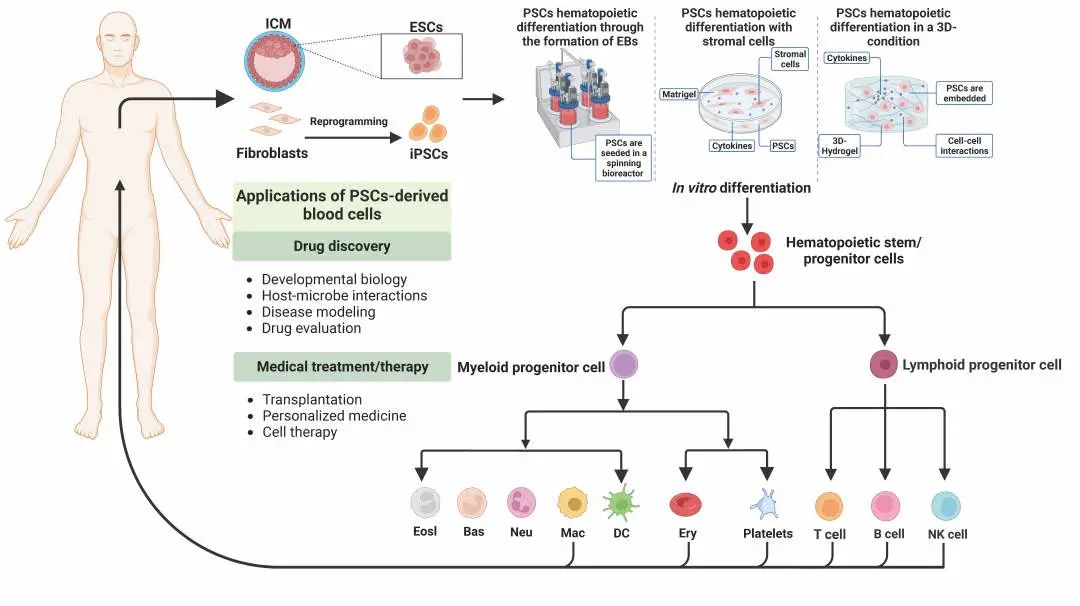
体外诱导hPSCs生成血细胞的方法及hPSCs来源血细胞的潜在应用
目前体外产生HSPCs的方法有拟胚体的形成、基质细胞系共培养、添加细胞因子和小分子等,但这些方法的培养环境与体内复杂环境差别较大。近期有研究采用了三维(3D)培养系统,如自组装肽水凝胶可以模拟体内造血微环境以提高造血分化的效率。基于造血干细胞起源于造血内皮细胞(hemogenic endothelium, HE)的研究基础,研究人员将先hPSCs诱导成HE,再进一步分化成有功能的HSPCs,这一分化体系很好地模拟了体内造血过程,具有较大的应用前景。此外,也有研究通过在小鼠体内形成畸胎瘤的方式来生成HSPCs。
目前,从hPSCs到淋巴细胞的体外分化体系相对成熟,而CAR改装过的hPSCs再诱导成相应的CAR-T和CAR-NK也为细胞免疫治疗提供了全新的思路。而相较于传统的CAR-T,CAR-NK具有无需HLA匹配、与治疗相关的毒性和GVHD发生率较低等优势。之前的研究已经证明了人ESCs和OP9共培养过程中具有分化为B细胞的潜能,但从hPSCs体外产生具有功能的B细胞仍具挑战性。
通过HSPCs与OP9或C3H10T1/2基质细胞共培养、调控关键基因可以提高血小板的产量。在临床应用中,为了防止输血不匹配,需要生产普适性高的血小板。近期有研究通过CRISPR/Cas9技术从hPSCs中敲除HLA class I分子从而产生通用型血小板。目前体外诱导生成的红细胞的成熟β-珠蛋白表达和脱核率都很低,因此,探索诱导生成的红细胞和体内天然生成的红细胞的差异可能是一个重要突破口。
相较于淋系和红系,髓系的体外分化受到的关注较少,通过使用不同组合的细胞因子,可以更适合地产生特定类型的髓系细胞。目前hPSCs诱导的巨噬细胞已经用于与癌症治疗相关的研究;hPSCs诱导的肥大细胞可以作为临床上对过敏原的新型测试系统。
hPSCs的无限增殖能力具有很高的临床价值,但是其在应用上仍具有一定的局限性,比如成瘤性、免疫原性和异质性。为了提高临床应用的安全性,可以提高hPSCs来源的血细胞的纯度或让hPSCs携带自杀基因。目前,尽管有多种方法可用来提升hPSCs来源的血细胞的产量和成熟度,但大规模生产适用于临床的成熟血细胞仍较为困难。提高hPSCs来源血细胞的成熟度,开发经济、高效、成分明确的无血清诱导体系,利用能够模仿体内环境的生物反应器,有望解决hPSCs来源血细胞面临的转化困境,为血液病患者带来福音。