
来源:BioArt
人类胚胎植入后能否正常发育,很大程度上取决于胚胎外组织的形态发生及其对胚胎细胞组织的影响,但受限于伦理和技术挑战,目前仍缺乏能反映人类胚胎着床后空间组织形态发生的模型,而该模型的构建对于解决生育和胚胎发育缺陷等问题而言至关重要。
2022年8月1日,以色列魏茨曼研究所的Jacob H. Hanna团队等在Cell杂志上合作发表了一项研究成果,证明小鼠原始态胚胎干细胞(naïve ESCs)具备在子宫外自组装成具有空间组织形态发生能力的胚胎(之前称为sEmbryos,后更名为SEMs)【1】。受此启发,他们想测试是否可以诱导人类多能干细胞在宫外动态发育至原肠胚阶段。
2023年9月6日,Jacob H. Hanna团队在Nature杂志上发表了一篇题为“Complete human day 14 post-implantation embryo models from naïve ES cells”的文章,证明未经基因修饰的人类naïve ESCs也可经诱导自组装为能再现着床后人类胚胎几乎所有已知谱系和结构的SEMs(如上下胚层等),这些SEMs还能动态模拟从受精后7-8天到13-14天的关键发育特征,这一平台的构建将有助于人们了解人类胚胎植入早期阶段的未知事件。

类似于在小鼠中,若想由naïve PSCs获取原始内胚层细胞谱系(Primitive endoderm,PrE)和滋养层干细胞谱系(Trophoblast stem cells, TSC),需要在最佳条件下瞬时过表达转录因子Gata4或Cdx2加以快速诱导。人类胚胎(而非小鼠胚胎)着床后会形成胚外中胚层(ExEM)结构,于是作者用人类PrE和ExEM调节因子GATA4和GATA6分别诱导人ESCs并用FACS染色标志物(PDGFRa+)以确定最佳诱导条件,同时用CDX2诱导人ESCs至滋养层细胞谱系(trophoblast, Tb),通过校准这些细胞的聚集条件,如不同阶段所需细胞数量、比例和培养基成分等,使诱导的Tb样细胞与PrE/ExEM样细胞聚集以组装成完整的类胚胎结构。
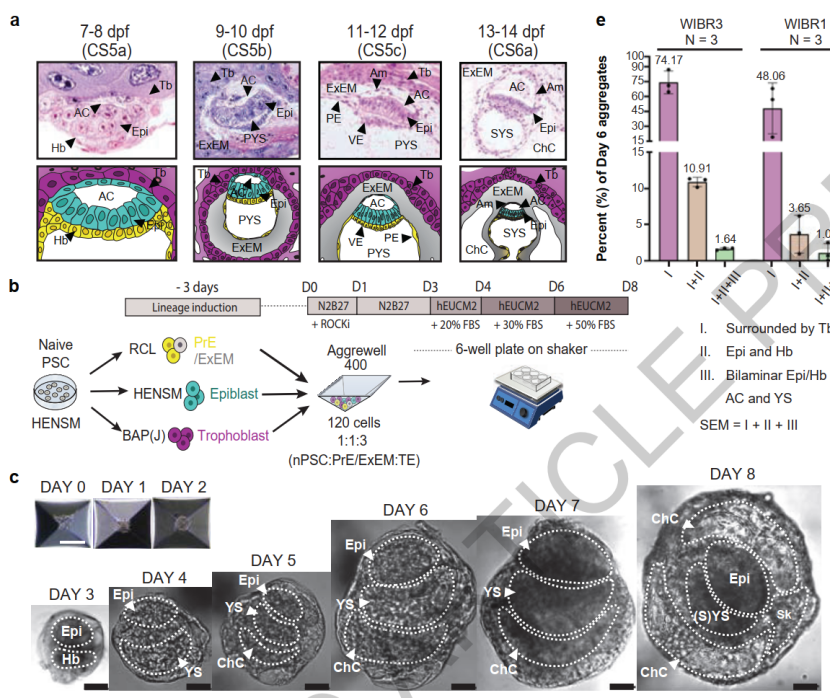 图1. 人类naïve ESCs完全自组装为SEM的方案和体外培养条件下的SEM结构明场图。
图1. 人类naïve ESCs完全自组装为SEM的方案和体外培养条件下的SEM结构明场图。
在子宫外培养的3-4天,这些细胞自发形成3D球形结构并能反映植入子宫时Tb样细胞包裹在SEM最外侧的结构特征,其内则为分别表达OCT4和SOX17的上胚层(Epi)样和下胚层(Hyp)样细胞,到第6天上胚层样区室开始形成羊膜样腔(AC),而下胚层样区室则开始形成卵黄囊样腔(YS),并在两者之间形成双层盘状结构,类似于人类9-10 dpf的胚胎状态。在此基础上,他们更详细地描述了人类SEMs中关键谱系的发育特征,比如对 SEM中的TFAP2A和ISL1进行免疫染色,以从定位、形态和基因表达上证实Epi样区室表现出的羊膜样特征等。此外,研究者还利用Chromium 10X scRNA-seq对SEMs进行单细胞转录组分析,并基于细胞特异性标记物的表达以证实SEM中各细胞身份定义的有效性,并将转录谱与由6个人类胚胎数据集【2-7】进行比较以验证SEMs与早期人类胚胎细胞类型组成的相似性。
总之,这项工作在子宫外生成了可自组织再现宫内早期胚胎3D结构和关键发育标志的人类SEMs,且在此过程中无需提供定向信号诱导,虽然该模型与人类胚胎并不完全相同,但也有助于实现对胚胎发育关键事件研究的目的。在本研究中,该团队观察到人类SEM的构建存在“低效率”和“发育阶段可变(不稳定)”的问题,未来在进一步优化培养条件的同时,还需要进一步测试该模型是否能继续完成原肠胚阶段的发育并形成各种器官。
原文链接:https://doi.org/10.1038/s41586-023-06604-5
参考文献:
1.Tarazi, S. et al. Post-gastrulation synthetic embryos generated ex utero from mouse naive ESCs. Cell 185, 3290-3306.e25 (2022).
2.Zhao, C. et al. Reprogrammed blastoids contain amnion-like cells but not trophectoderm.bioRxiv 2021.05.07.442980 (2021) doi:10.1101/2021.05.07.442980.
3. Yan, L. et al. Single-cell RNA-Seq profiling of human preimplantation embryos and embryonic stem cells. Nat Struct Mol Biol 20, 1131–1139 (2013).
4. Yanagida, A. et al. Naive stem cell blastocyst model captures human embryo lineage segregation. Cell Stem Cell 28, 1016-1022 (2021). doi:10.1016/j.stem.2021.04.031.
5. Petropoulos, S. et al. Single-Cell RNA-Seq Reveals Lineage and X Chromosome Dynamics in Human Preimplantation Embryos. Cell 165, 1012-1026 (2016).
6. Meistermann, D. et al. Integrated pseudotime analysis of human pre-implantation embryo single-cell transcriptomes reveals the dynamics of lineage specification. Cell Stem Cell 28,1625-1640.e6 (2021).
7. Xiang, L. et al. A developmental landscape of 3D-cultured human pre-gastrulation embryos. Nature 2019 577:7791 577, 537–542 (2019).