
来源:BioArt
阿尔兹海默症(Alzheimer's Disease,AD)是老年人群中最常见的一种神经退行性疾症,其发病机制至今尚未完全阐明, 目前还没有彻底治愈的方法。近年来全基因组关联研究(GWAS)和相关遗传学研究揭示了数以千计的单核苷酸多态位点(SNP)与阿尔兹海默症相关。由于阿尔兹海默症发病机制极为复杂,关联位点大都处于基因组非编码区,到底哪些位点会增加阿尔兹海默症的发病风险,其具体效应及作用机制尚待进一步研究。
基因组非编码区存在大量具有潜在基因表达调控功能的顺式作用元件(candidate cis-regulatory element, cCRE),如增强子、沉默子等,可以通过与启动子远距离相互作用,调控靶基因转录活性。前期研究表明,超过90%的阿尔兹海默症关联位点富集在cCRE序列中,因此阐释这些cCRE对靶基因的调控功能是解析阿尔兹海默症遗传风险的关键。作为大脑中的免疫细胞,小胶质细胞不仅在免疫应答、监测以及维持脑内免疫稳态方面发挥着重要作用,而且相对于神经元、星状胶质细胞和少突胶质细胞,与阿尔兹海默症相关的关联位点更多富集于小胶质细胞的cCRE序列中 ,提示小胶质细胞对于阿尔兹海默症关联位点的cCRE研究及其遗传机制的深入解析具有重要意义。
2023年9月21日,加州大学旧金山分校 (University of California, San Francisco) 沈音课题组及北卡罗来纳大学教堂山分校 (University of Northa Carolina, Chapel Hill)的李蕴课题组在Nature Genetics杂志上发表了题为 Functional characterization of Alzheimer’s disease genetic variants in microglia 的论文,首次将小胶质细胞表观遗传学信息与阿尔兹海默症GWAS数据相结合,系统性鉴定了与阿尔兹海默症高度相关的遗传位点,并利用单细胞CRISPR干扰筛选技术阐释了多个阿尔兹海默症关联位点通过远距离染色体相互作用调控靶基因表达,并影响小胶质细胞生理功能,为全面解析阿尔兹海默症的遗传机制提供了研究范例。

已有研究表明,病毒感染可导致多种神经退行性疾病的罹患风险显著升高【1】。因此,作者考察了人类多功能干细胞(hPSC)分化得到的小胶质细胞在静息和干扰素IFNβ刺激(模拟病毒感染)两种状态下不同的转录谱 (RNA-seq)、开放的染色质区域图谱 (ATAC-seq) 以及高精度的3D染色质相互作用图谱 (promoter capture Hi-C) ,来阐释小胶质细胞在静息和应对病毒感染两种状态下基因表达调控机制。有趣的是,作者发现大多数干扰素刺激导致的差异表达基因对应的染色质开放状态和3D相互作用在刺激前后保持相对稳定,表明细胞已经具备大部分的快速应对刺激转录调控变化的先决条件。另一方面,染色质开放状态和3D相互作用同时发生变化的基因更倾向有表达变化。例如在阿尔兹海默症风险基因MS4A6A下游的一个cCRE中含有两个遗传位点。经过干扰素刺激后,该cCRE表现出更强的染色质开放状态, 并与MS4A6A启动子发生更强的3D相互作用。这些表观遗传现象很好地解释了干扰素刺激后MS4A6A的转录水平升高,提示该cCRE的遗传位点可以通过调节免疫反应基因来增加个体患阿尔兹海默症的风险。
接下来,研究人员将与阿尔兹海默症相关的非编码遗传位点和人源小胶质细胞三维表观基因组图谱相结合,揭示了位于181个cCRE中的308个新的强关联阿尔兹海默症相关遗传位点。通过检查对附近基因转录的等位效应,作者进一步优先考虑了来自25个基因座的118个位点。研究团队对这些被优先考虑的位点和cCREs的功能研究揭示了一系列跟阿尔兹海默症相关的遗传机制。例如,通过在人源小胶质细胞中的单细胞CRISPR干扰筛选实验,作者观察到单个阿尔兹海默症相关功能位点可以影响多个基因的表达,多个cCREs的联合作用可以对靶基因的表达产生非线性的协同作用。这些结果凸显了通过非编码区介导的转录调控所驱动的阿尔兹海默症发病风险的复杂性,也强调了研究cCREs在基因调控中联合效应的重要性。
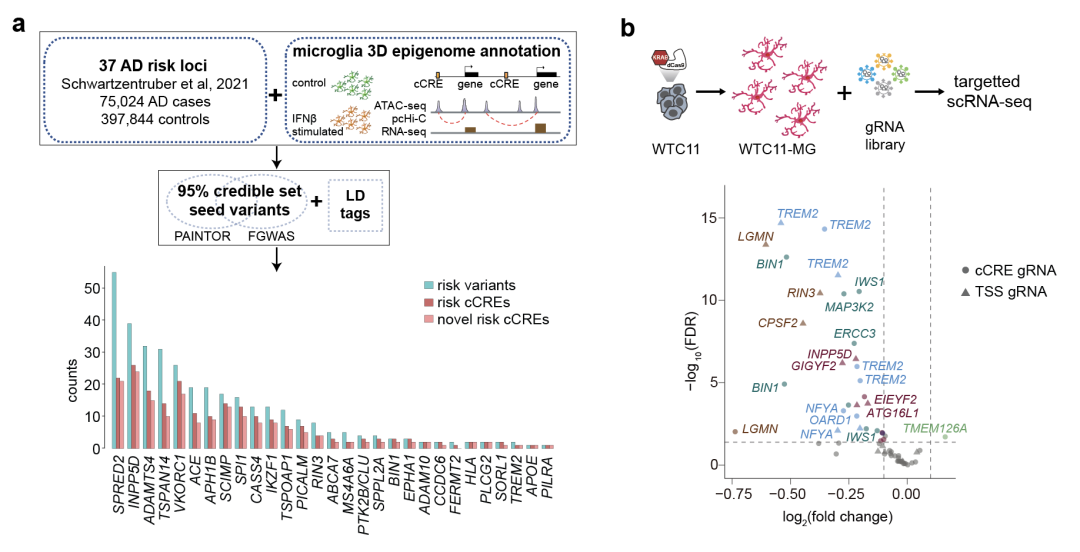
此外,研究团队还采用先导编辑(prime editing)技术【2】,对风险基因TSPAN14内含子区域同一个cCRE中的两个位点进行基因编辑和等位基因表达分析,确定了rs7922621定向调控TSPAN14基因表达,并进一步影响下游ADAM10的膜转运及可溶性TREM2的剪切过程。考虑到TSPAN14、ADAM10和TREM2都是阿尔兹海默症的风险基因,此项研究实现了在小胶质细胞中对阿尔兹海默症相关变异的作用机制进行了系统性评估,涵盖了从遗传精细预测到将遗传关联位点与疾病相关的分子和细胞水平的功能联系起来的全流程程。
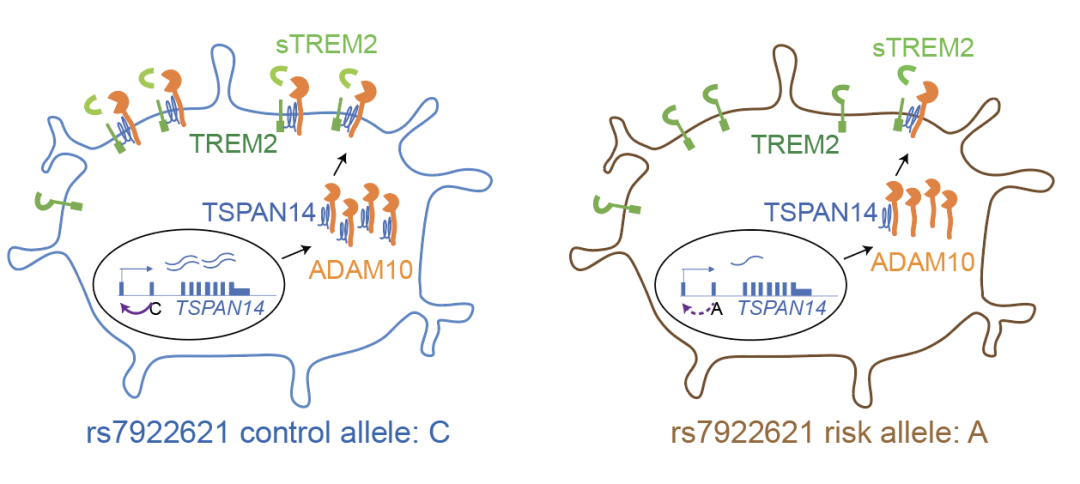
值得强调的是,本研究TSPAN14位点的结果表明处于同一个cCRE中的rs7922621与其完全正相关的位点rs7910643并没有表现出以上的分子或细胞层面的功能,凸显了先导编辑的单碱基水平对精准解析基因组功能的重要性。通常在同一个cCRE中存在多个与复杂疾病相关的遗传位点,精准定位致病位点困难重重:因为一般的基因编辑方法,比如CRISPR,很难达到单个碱基的精度。沈音课题组近来开发了PRIME(高通量单碱基原位编辑筛选)方法,实现了以单碱基分辨率高通量地对人类基因组进行功能筛选【3】。这项技术将显著提升我们阐释复杂疾病遗传机制、提高早期诊断与风险评估、新药研发,以及开发个体化治疗方案的能力。
本次研究还得到了来自海伦和罗伯特·阿尔兹海默症研究所/威尔康奈尔医学院甘丽 (Li Gan) 教授团队的鼎力支持(Helen and Robert Appel Alzheimer’s Disease Research Institute, Weill Cornell Medical College)。沈音课题组杨晓宇(Xiaoyu Yang) 博士为文章第一作者。
原文链接:https://www.nature.com/articles/s41588-023-01506-8
参考文献:
1.Levine, K. S. et al. Virus exposure and neurodegenerative disease risk across national biobanks. Neuron, doi:10.1016/j.neuron.2022.12.029 (2023).
2.Anzalone, A. V. et al. Search-and-replace genome editing without double-strand breaks or donor DNA. Nature 576, 149-157, doi:10.1038/s41586-019-1711-4 (2019).
3.Ren, X. et al. High throughput PRIME editing screens identify functional DNA variants in the human genome. bioRxiv, 2023.2007. 2012.548736 (2023).