
来源: BioArt
骨髓驻留的造血干细胞和多能祖细胞 (hematopoietic stem and multipotent progenitor cells HSPC)维持终生血液形成,但它们的功能会随着衰老而下降。调控造血干细胞和多能祖细胞稳态的机制尚不完全清楚,特别是那些调节命运、确保长期功能维持和预防衰老相关的机制。
与其他几种成体干细胞一样,HSPC大多处于静止状态,仅在独特的内在信号和外在信号的作用下进行细胞分裂,并有助于成熟血细胞的产生或补充干细胞池。每次细胞分裂都需要大量的分子参与以满足有丝分裂不断变化的能量和结构需求。由于这些变化在很大程度上与其持续维持的长期功能不相容,干细胞必须抵消与有丝分裂相关的分子改变——迄今为止其中的机制仍然不清楚。
来自Albert Einstein医学院的Britta Will团队在之前的研究中揭示了铁螯合化合物增强人类和小鼠 HSPC 再生活性的能力,表明细胞内不稳定铁可能发挥关键作用。
近日,该课题组在Cell Stem Cell 上发表题为An iron rheostat controls hematopoietic stem cell fate 的文章。本文探讨了铁在调节造血干细胞命运中的作用,提出游离细胞质铁作为成年干细胞命运决定的调节器。HSPC细胞存在铁限制,衰老造血干细胞中细胞质铁的积累降低了它们的再生能力。

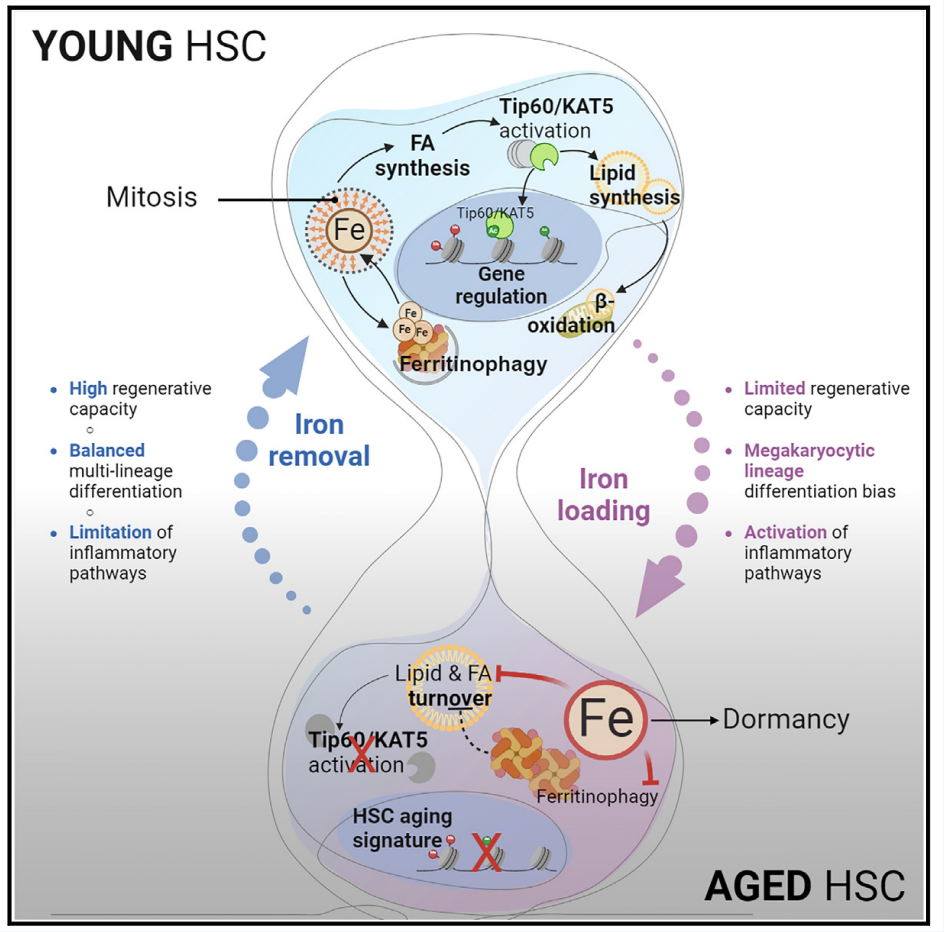
作者首先量化了细胞中的不稳定铁库(intracellular labile iron pool LIP)的大小。作者用亚铁化学传感器和流式细胞量化大鼠未成熟造血细胞区室中的细胞的LIP大小。结果显示HSPC 在未成熟造血细胞中具有较小且易于检测的LIP。LIP在一些亚细胞群中会被激活。而进一步研究表明有限铁反应的激活会增加 HSPC 的再生功能。
接下来作者用去铁胺建立瞬时实验性铁限制小鼠体内模型。作者对年轻小鼠(2-3月)每日注射,持续14天。分析发现细胞内铁限制增强了HSC 的再生能力,且长期 LIP 限制可能有利于在衰老过程中保护 HSPC 功能。LIP 限制提高了衰老HSPC 的再生能力。进一步检测发现衰老HSPC 中会发生铁负载和 LIP 扩张,并提高了铁介导的命运决定的可能性。作者接下来提出干细胞依赖铁进行细胞命运调控。铁稳态对于长期再生过程中 HSC 的命运控制至关重要,并且铁反应性基因调控保留了 HSC 中的干性程序。
作者接下来探索其中起作用的潜在分子机制。研究发现铁反应性基因调控由 Tip60 控制。减轻细胞内铁负荷可恢复衰老 HSC 中的 Tip60 活性。LIP 限制增加脂肪酸周转,调控脂肪酸代谢,增强铁依赖性再生 HSPC 活性。
该文章发现造血干细胞中游离铁的水平相对较低。研究通过开发模型来检查铁限制的影响,并使用各种分析技术表明,限制铁响应的激活触发了代谢和表观遗传变化,这些变化建立了对干细胞特性至关重要的基因调控。研究还指出,衰老造血干细胞中细胞质铁的积累可逆转地降低了它们的再生能力,为衰老相关的干细胞功能障碍提供了可能的干预措施。
原文链接:https://doi.org/10.1016/j.stem.2024.01.011