
表观遗传重编程重置亲本的表观遗传记忆,并将原始生殖细胞(PGCs)分化为有丝分裂前精原细胞或卵原细胞,确保性别差异的生殖细胞发展以及全能性。在体外重构人类的表观遗传重编程仍是一个基本挑战。

近日,京都大学iPS細胞研究所Mitinori Saitou团队在《nature》杂志上发表题为“In vitro reconstitution of epigenetic reprogramming in the human germ line”文章,本研究利用诱导多能干细胞(iPSC)来源的人类类PGC(hPGCLCs)进行表观遗传重编程和分化成有丝分裂前精原细胞或卵原细胞,并伴随其广泛的扩增(约1010倍)。
值得关注的是,骨形态发生蛋白(BMP)信号是这些过程的关键驱动因素:BMP驱动的hPGCLC分化涉及减弱丝裂原活化蛋白激酶/细胞外调节蛋白激酶(MAPK/ERK)途径以及新生和维持DNA甲基转移酶(DNMT)活性,可能促进复制耦合的被动DNA去甲基化。另一方面,缺乏 TET-1 的hPGCLCs(一种在人类生殖细胞中丰富的主动DNA去甲基酶)分化为胚外细胞,包括羊膜,且有关键基因启动子的去抑制;这些细胞未能充分激活对精子生成和卵子生成至关重要的基因,其启动子保持甲基化状态。
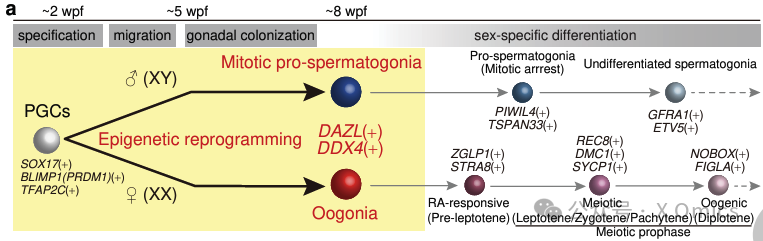
生殖细胞赋予了全能性并确保了遗传和进化。人类的原始生殖细胞(hPGCs)被认为是在大约胚胎第12-16天(受精后2周)在早期胚胎种植后的羊膜或后胚层中特定的。它们通过卵黄囊和后肠内胚层迁移,从大约5-6周后开始殖民生殖脊。在此期间,hPGCs启动表观遗传重编程,通过全基因组DNA去甲基化(5-甲基胞嘧啶去甲基化)和组蛋白修饰重塑来重置亲本的表观遗传记忆。到了大约7-8周后,hPGCs显示出重编程的完成,并分化为有丝分裂前精原细胞或卵原细胞,分别为精原细胞或卵细胞分化的前体。
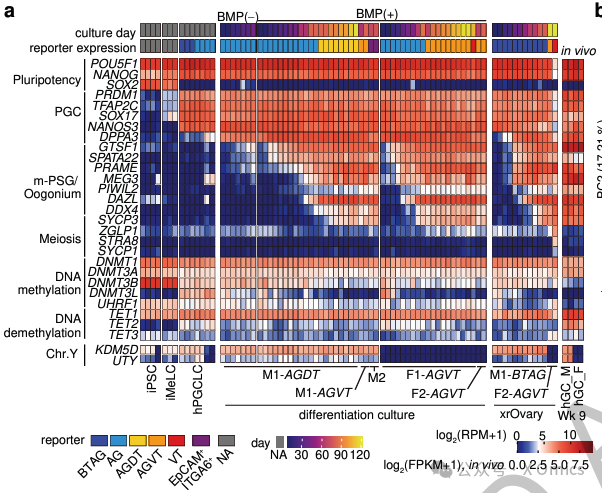
BMP信号稳定生殖细胞命运的发现,类似于BMP信号通过阻断分化来维持胚胎干细胞自我更新的作用。考虑到抑制MAPK/ERK信号在诱导伴随DNMTs抑制和DNA甲基组重编程的原始多能性中起关键作用,类似机制可能也适用于hPGCLC的分化。BMP信号及其在其他物种PGC表观遗传重编程中的相关性值得进一步研究。
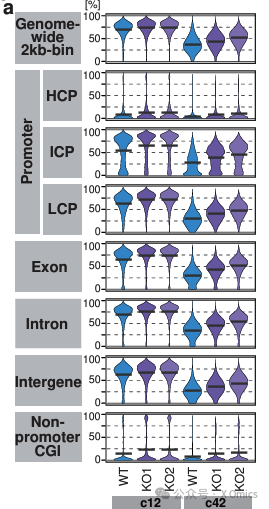
在小鼠中,Tet1本身对全基因组DNA去甲基化不是必需的,但对维持精子生成和卵子生成关键基因以及印记DMR的去甲基化至关重要。为了更好地理解人类中TET功能的表观遗传重编程,将需要评估催化突变体,同时保持其转录抑制活性完好无损。
本研究阐明了人类表观遗传重编程的框架,为人类生物学做出了根本性进展,并通过生成大量的有丝分裂前精原细胞和类卵原细胞,代表了人类体外配子生成研究及其潜在的生殖医学转化的里程碑。
原文链接:https://doi.org/10.1038/s41586-024-07526-6