
来源:国家药监局药审中心(CDE)、各公司官网
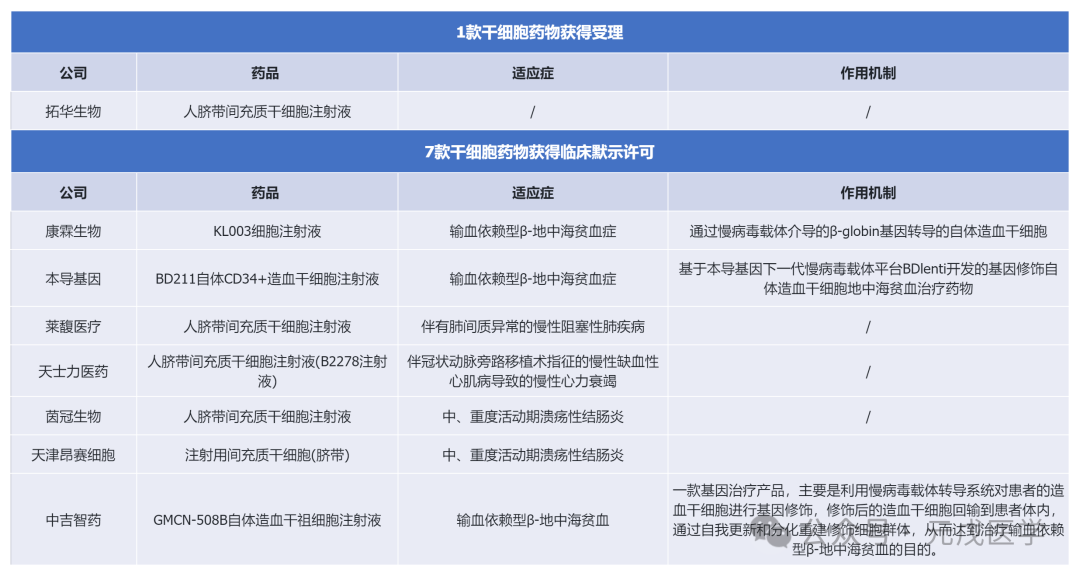
2024年1月,国家药监局药审中心(CDE)受理1款干细胞相关药物,为人脐带间充质干细胞注射液;临床默示许可7款干细胞相关药物,为造血干细胞注射液、脐带间充质干细胞注射液等。
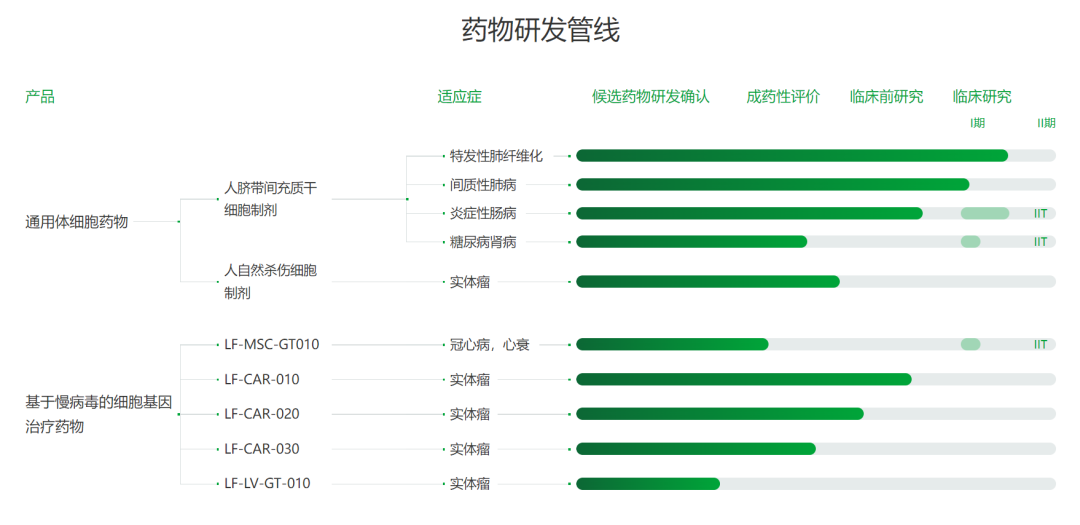
人脐带间充质干细胞(hUC-MSCs)具有增殖能力强、免疫原性低、取材方便、伦理争议小等优势,研究结果显示其具有免疫调节、组织修复作用,在肺损伤性疾病治疗方面表现出一定的治疗潜力,有望取得突破性进展,目前其作用越来越受到重视。
造血干细胞(HSCs)是一类具有自我更新能力并多向分化进而产生不同谱系成熟血细胞的一类成体干细胞。自体造血干细胞移植就是把患者自己的干细胞采集保存,然后经过预处理、强烈化疗,再把保存的干细胞输回到患者体内的过程。主要用于治疗淋巴瘤、多发性骨髓瘤及白血病。该项技术属于第三类高风险技术,是细胞类技术,也是限制性技术。
拓华生物
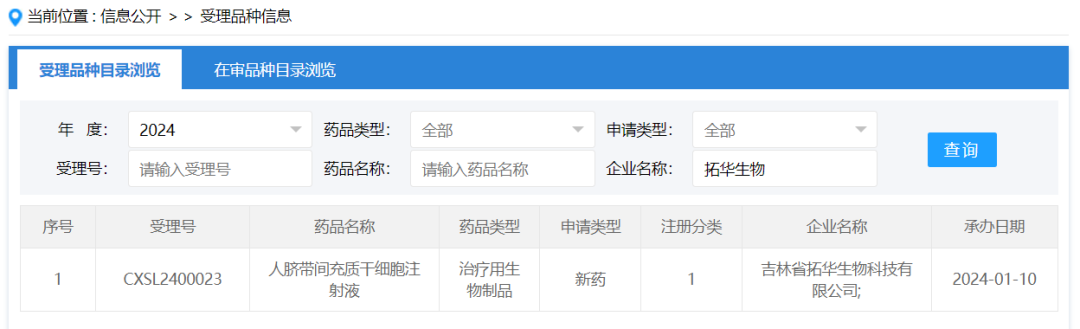
2024年1月10日,吉林省拓华生物科技有限公司按新药1类提交的“人脐带间充质干细胞注射液”的临床试验申请获得受理,受理号:CXSL2400023。这是该款细胞注射液的第2种适应证获得受理,此前其全资子公司苏州拓华生物科技有限公司的“人脐带间充质干细胞注射液”已获得临床默示许可,适应症为中/重度急性呼吸窘迫综合征,受理号:CXSL2300152。
吉林省拓华生物成立于2010年12月,是一家专业从事干细胞基础研究、临床应用研究及干细胞技术服务的生物高科技有限公司,致力于各种难治性疾病如帕金森病、脑瘫、糖尿病、股骨头坏死和肿瘤等疾病的细胞产品研究和临床应用研究。在上海、深圳等前沿城市投资建设了多家脑病中心、肾病医院和抗衰老中心等医疗机构,同时开发了自主品牌"薇珂·美伦”和“一剪时光”细胞修复活性肽以及超氧化物歧化酶蛋白粉系列的美容妆品和保健食品等。
康霖生物
2024年1月3日,康霖生物科技(杭州)有限公司按新药1类提交的“KL003细胞注射液”(通过慢病毒载体介导的β-globin基因转导的自体造血干细胞)获得新药临床试验默示许可,受理号:CXSL2300699,适应证为输血依赖型β-地中海贫血症。此为康霖生物首款默示许可的干细胞药物。
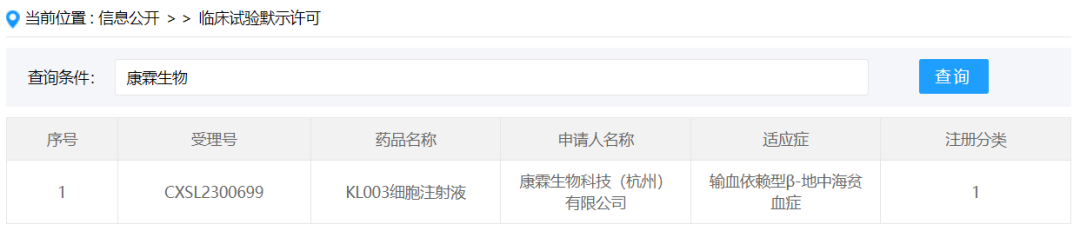
KL003细胞注射液是一款基因修饰自体造血干细胞产品,通过慢病毒载体介导的β-globin基因转导自体造血干细胞并回输,在患者体内分化出表达功能正常的β-globin的红细胞,恢复患者血红蛋白水平,从而摆脱输血依赖,达到一次性功能性治愈的效果。
康霖生物成立于2015年8月,是一家以做首创药物和同类最优创新基因药物为目标的国家级专精特新小巨人企业,其主导的帕金森病基因治疗项目已完成临床前研究,正准备开展研究者发起的临床试验。
本导基因
2024年1月3日,上海本导基因技术有限公司按新药1类提交的“BD211自体CD34+造血干细胞注射液”获得新药临床试验默示许可,受理号:CXSL2300710,适应证为输血依赖型β-地中海贫血症。BD211是本导基因第二款获得IND批件的管线,因此,本导基因在基因编辑与基因补偿两大基因治疗路线上均有管线进入了注册临床试验阶段。
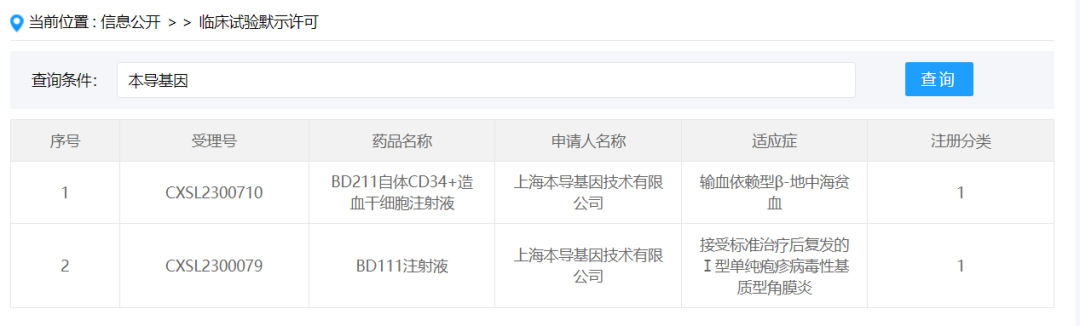
BD211是一款基于本导基因下一代慢病毒载体平台BDlenti开发的基因修饰自体造血干细胞地中海贫血治疗药物,具有以下优势和特点:首先通过引入专利性绝缘子设计,降低慢病毒载体的整合突变风险,提升了产品安全性;其次,优化了β珠蛋白基因表达序列,通过基因补偿将患者的血红蛋白修复至健康人的生理状态,提高了治疗效果。
本导基因成立于2018年7月,是一家以体内基因编辑治疗为特色的基因治疗创新药物研发企业,致力于为眼科、神经系统、造血系统、病毒感染以及肿瘤等多领域的难治性疾病开发具有全球意义的创新药物。本导基因拥有国际领先VLP mRNA递送平台(BD-VLP)和下一代慢病毒载体平台(BDlenti)。围绕着核心递送技术平台布局了多条First-in-Class的产品管线,开展了多项First-in-Human临床研究;基于两大核心递送技术的管线BD111和BD211均进入了正式临床阶段。

莱馥医疗
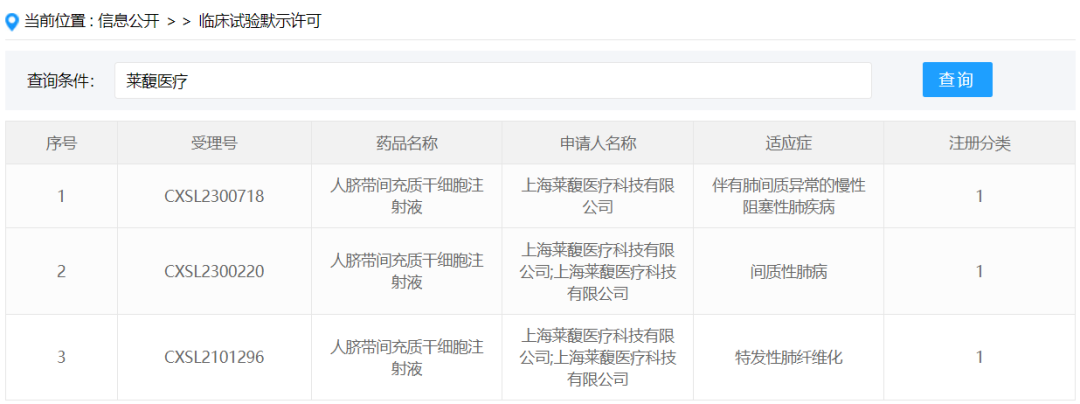
2024年1月,上海莱馥医疗科技有限公司按新药1类提交的“人脐带间充质干细胞注射液”获得新药临床试验默示许可,受理号:CXSL2300718,适应证为伴有肺间质异常的慢性阻塞性肺疾病。此前,该款干细胞制剂已默示许可用于特发性肺纤维化(受理号:CXSL2101296)和间质性肺病(受理号:CXSL2300220)。
莱馥医疗成立于2016年11月,是一家拥有创新细胞和基因药物(CGT)发现、研发、工艺开发和生产全功能的临床阶段的生物制药公司,在细胞治疗、基因治疗、组织修复和再生等领域前瞻性布局新药研发。
天士力医药
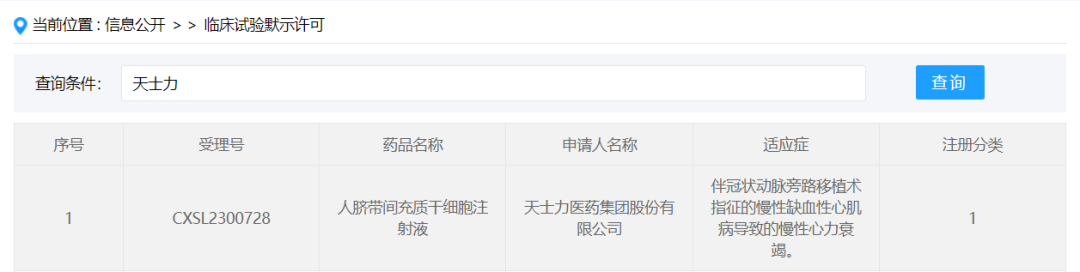
2024年1月18日,天士力医药集团股份有限公司按新药1类提交的“人脐带间充质干细胞注射液(B2278注射液)”获得新药临床试验默示许可,受理号:CXSL2300728,适应证为伴冠状动脉旁路移植术指征的慢性缺血性心肌病导致的慢性心力衰竭。此为天士力首款默示许可的干细胞药物。
2278注射液由上海市东方医院(同济大学附属东方医院)研发,2022年8月天士力与东方医院签署《技术转让(合作)合同》,由天士力受让B2278注射液的相关技术及成果,并在全球范围内,优先在中国开展药品注册申报及后续临床试验开发。临床前研究证明B2278注射液可通过旁分泌作用调控心肌组织微环境,对于缺血性心肌病中的心肌细胞组织损伤有明显抑制作用,增加动物心功能,促进血管再生,减少心肌凋亡。
天士力医药成立于1998年4月,主营业务囊括现代中药领域、生物药领域、化学药领域和干细胞与再生医学,利用现代中药、生物药、化学药协同发展优势进行创新药物,持续聚焦中国市场容量最大、发展最快的心脑血管、消化代谢、抗肿瘤三大治疗领域。
茵冠生物
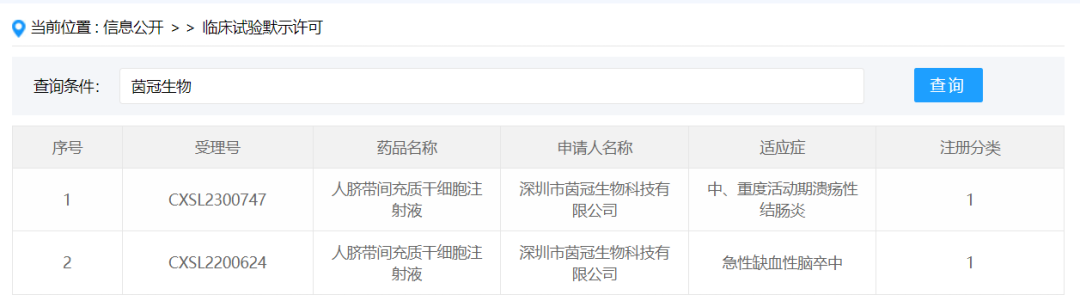
2024年1月22日,深圳市茵冠生物科技有限公司按新药1类提交的“人脐带间充质干细胞注射液”获得新药临床试验默示许可,受理号:CXSL2300747,适应证为中、重度活动期溃疡性结肠炎。此前,该款干细胞制剂已默示许可用于急性缺血性脑卒中,受理号:CXSL2200624。
茵冠生物成立于2013年3月,致力于细胞制药与人类健康。首款“人脐带间充质干细胞注射液”在北京天坛医院等3家中心开展治疗急性缺血性脑卒中的I/IIa期临床研究,目前已成功完成首例患者入组且完成了剂量限制性毒性(DLT)评价。同期其余药物管线正聚力推进中。
天津昂赛细胞
2024年1月25日,汉氏联合旗下汉联药业板块子公司天津昂赛细胞基因工程有限公司按新药1类提交的“注射用间充质干细胞(脐带)”获得新药临床试验默示许可,受理号:CXSL2300760,适应证为中、重度活动期溃疡性结肠炎。此前,该款干细胞制剂已默示许可用于移植物抗宿主病(受理号:CXSL1800101)、慢加急性(亚急性)肝衰竭(受理号:CXSL2000335)、急性呼吸窘迫综合征(受理号:CXSL2100056)、外伤性脊髓损伤(受理号:CXSL2200553)。

天津昂赛细胞成立于2004年10月,为汉氏联合集团旗下绝对控股子公司,主要从事干细胞药物研发、再生医疗相关组织工程产品以及细胞质量评价技术开发。2006年建立了脐带间充质干细胞库,具备良好的干细胞工程技术开发能力,建立了成体干细胞分离、成体干细胞大规模扩增等7个行业关键技术平台。
中吉智药
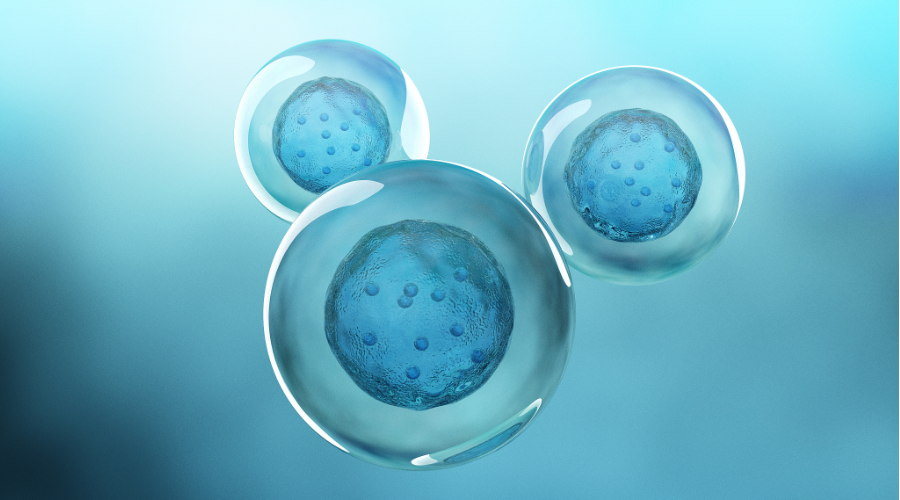
2024年1月26日,中吉智药(南京)生物技术有限公司按新药1类提交的“GMCN-508B自体造血干祖细胞注射液”获得新药临床试验默示许可,受理号:CXSL2300761,用于治疗输血依赖型β-地中海贫血。此为中吉智药首款默示许可的干细胞药物。
508B是一款基因治疗产品,主要是利用慢病毒载体转导系统对患者的造血干细胞进行基因修饰,修饰后的造血干细胞回输到患者体内,通过自我更新和分化重建修饰细胞群体,从而达到治疗输血依赖型β-地中海贫血的目的。
中吉智药(南京)成立于2020年9月,专注于造血干细胞相关疾病,是一家基因治疗创新药物企业。公司已完成多轮融资,步入临床阶段。
随着越来越多的干细胞新药进入临床阶段,我们期待干细胞治疗在未来医疗领域得到广泛应用。