
2024年4月,国家药监局药审中心(CDE)共受理2款、临床默示许可1款干细胞相关药物,分别为人脐带间充质干细胞注射液、人羊膜间充质干细胞注射液等。
艾尔普再生医学
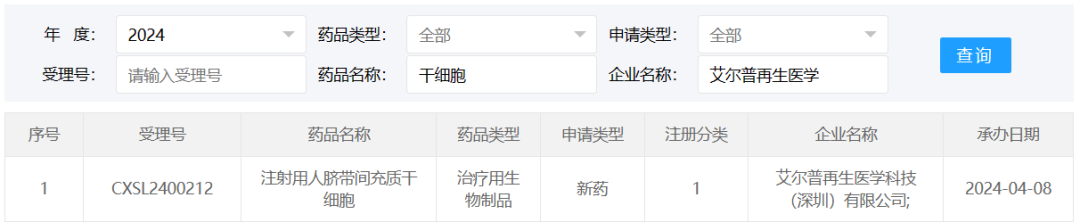
2024年4月8日,艾尔普再生医学科技(深圳)有限公司研发的“注射用人脐带间充质干细胞“的临床试验申请获得受理,受理号为CXSL2400212。
艾尔普再生医学成立于2016年5月,已打造三大多体系智能化平台Help Cell-foundry:(1) 具备CRISPR/化学诱导/无动物源性等多元化体系的全球新一代基于智能计算驱动的iPSC重编程技术平台;(2) 结合半监督学习等机器学习方法的智慧型细胞质检平台;(3) 全自动化高规模工业级细胞智造平台。该技术成功入选2021年国家“十三五”科技创新成就展,在细胞量产与质量保障方面走在世界前列。围绕心衰与肿瘤免疫等疾病领域已布局多条研发管线,其中用于治疗中重度心衰的iPSC技术疗法已经进入全国多个权威中心,开展大规模随机对照人体临床试验。
源品细胞
2024年4月23日,源品细胞生物科技集团有限公司的”人羊膜间充质干细胞注射液“的临床试验申请获得受理,受理号为CXSL2400258。
源品生物致力于羊膜间充质干细胞治疗卵巢功能减退关键技术攻关,以临床问题为导向,已取得一定进展;前期研究显示,人羊膜间充质干细胞(hAMSCs)能有效改善早发性卵巢功能不全(POI)患者的卵巢功能。2023年12月,在《Reproductive Sciences》上发表了hAMSCs静脉注射治疗早发性卵巢功能不全(POI)安全性和有效性的相关研究,在不同动物种属开展了hAMSCs静脉注射治疗POI的急性毒性试验、长期毒性试验、组织分布试验、溶血试验和过敏试验,验证了hAMSCs静脉注射治疗POI模型动物的安全性和有效性,有望为临床中POI患者的干预提供一定的参考依据。
北科生物
2024年4月28日,深圳市北科生物科技有限公司自主研发的“人脐带间充质干细胞注射液”,获得国家药监局药审中心(CDE)的新药临床试验默示许可(IND),受理号为CXSL2400092,用于治疗中重度系统性红斑狼疮。这一创新成果标志着国内首个治疗中重度系统性红斑狼疮的间充质干细胞药物即将进入临床试验阶段。
北科生物是国内较早在细胞生物医药领域引入质量管理概念的企业,于2010年首次进行了ISO9001质量管理体系认证,并于2012年整合体系完成“质量、环境、职业健康安全”三标一体认证并已连续12年通过认证。同时北科生物江苏分公司在2012年在中国大陆引进并通过“血液和生物治疗发展协会”(Association for theAdvancement of Blood & Biotherapies,简称 AABB,原美国血库协会)认证的综合性细胞库;2017年5月,北科生物深圳细胞库(深圳综合细胞库)的四项自体细胞(人脐带来源间充质干细胞、人脐血来源造血干细胞、人胎盘来源间充质干细胞、人外周血免疫细胞)储存应用技术质量管理体系同时通过AABB认证。
随着越来越多的干细胞新药进入临床阶段,我们期待干细胞治疗在未来医疗领域得到广泛应用。