
细胞和基因治疗(CGT)领域前景广阔,2024年全球CGT疗法仍在大放异彩。据统计,2024年1-4月全球范围内共有5款CGT疗法获批上市,其中包括3款细胞疗法,2款基因疗法。
lovance:Amtagvi
2月17日,Iovance Biotherapeutics公司宣布,美国FDA加速批准其肿瘤浸润淋巴细胞(TIL)疗法Amtagvi(lifileucel)上市,用于治疗晚期黑色素瘤,定价51.5万美元。根据新闻稿,lifileucel是全球首款获批上市的TIL细胞疗法。
Amtagvi 是一种肿瘤衍生的自体T细胞免疫疗法。通过从患者体内获取肿瘤组织并且提取TIL,然后在体外使用IL-2细胞因子以刺激TIL的扩增。这一体外刺激手段不但增加了TIL的数量,还能激活TIL的抗肿瘤能力。然后这些TIL被注回患者体内,更有效地杀伤肿瘤细胞。Lifileucel展现具临床意义的抗肿瘤活性,患者的中位缓解持续时间(DOR)尚未达成(95% CI:8.3-尚未达成)。所有接受lifileucel单次注射的PD-1/PD-L1耐药晚期黑色素瘤患者(n=153)在第4年的总缓解率为21.9%,中位总生存期为13.9个月(95% CI:10.6-17.8)。
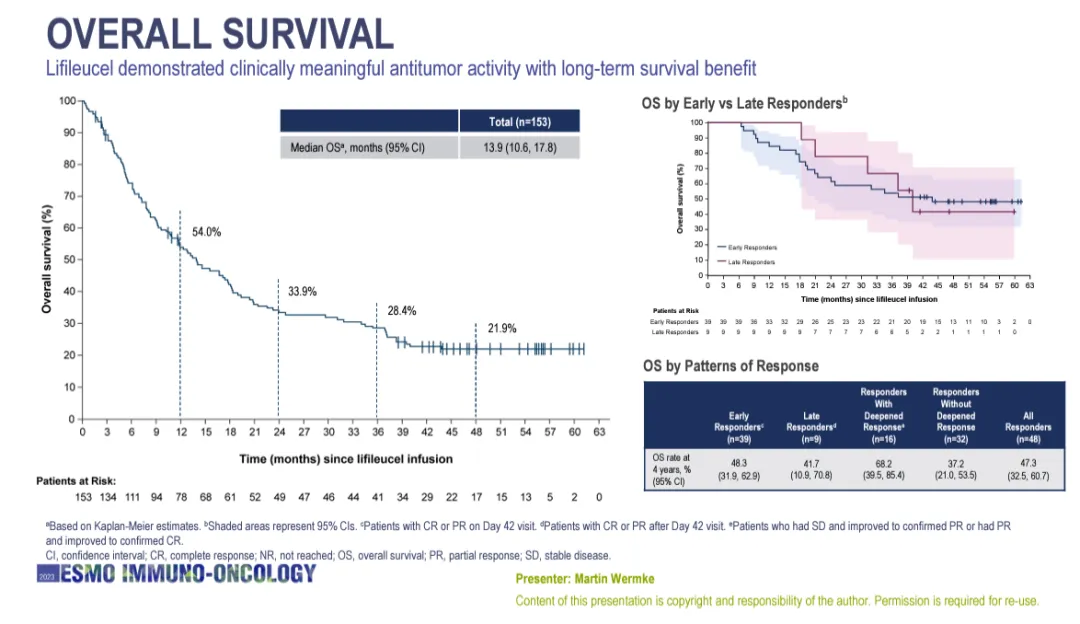
Lifileucel在中位随访4年时的总生存期数据
Iovance Biotherapeutics是TIL细胞疗法领域的领头羊。除了LN-144和LN-145,lovance公司管线中的LN-145-S1(PD-1选择性TIL疗法)、LN-145-Gen 3(第三代TIL疗法)也都已进入到了2期或3期临床试验阶段,涉及头颈鳞状细胞癌(HNSCC)、转移性非小细胞肺癌(NSCLC)等适应症。
科济药业:泽沃基奥仑赛注射液
3月1日,科济药业宣布,国家药监局(NMPA)已批准其BCMA CAR-T产品赛恺泽®(泽沃基奥仑赛注射液)新药上市申请(NDA),用于治疗复发或难治性多发性骨髓瘤成人患者,既往经过至少3线治疗后进展(至少使用过一种蛋白酶体抑制剂及免疫调节剂)。该注射液是国内第五款获批的CAR-T疗法,同时也是国内第二款靶向BCMA的CAR-T产品。
3月5日,科济药业披露该注射液(商品名:赛恺泽)的首发价格为115万元,经与合作方华东医药(000963.SZ)共同预估,该药年终端销售额的峰值预计可达10亿元以上。
泽沃基奥仑赛是一种自体BCMA靶向CAR-T细胞产品,它是通过慢病毒转导T细胞产生的。慢病毒编码的CAR包括全人源BCMA特异性单链可变片段(scFv),人CD8α铰链结构域、CD8α跨膜结构域、4-1 BB协同刺激结构域以及CD3ζ激活结构域。自研的新全人源scFv具有较高的结合亲和力和稳定性。
BMS:Breyanzi
3月14日,百时美施贵宝(Bristol Myers Squibb)宣布美国FDA已加速批准Breyanzi (lisocabtagene maraleucel;liso-cel)。这是一种靶向CD19的CAR-T细胞疗法,用于治疗复发/难治性慢性淋巴细胞白血病(R/R CLL)或小淋巴细胞淋巴瘤(SLL)成人患者,这些患者之前至少接受过两线治疗,其中包括BTK抑制剂和BCL-2抑制剂。新闻稿指出,这款细胞疗法是首款用于复发性或难治性CLL或SLL成人患者的CAR-T细胞疗法。
Breyanzi定价41万美元/针,是一种靶向CD19抗原的自体CAR-T细胞疗法,具有明确的组成和4-1BB共刺激域。它于2021年2月获FDA批准,用于治疗接受过两种或以上系统治疗的复发/难治性大B细胞淋巴瘤(LBCL)成人患者。这款疗法的独特之处在于CAR-T疗法中CD8阳性和CD4阳性T细胞的比例得到控制,从而可以更好地控制细胞疗法的毒副作用。4-1BB信号结构域则增强了CAR-T细胞的扩增和持久性。
此次获批基于的TRANSCEND CLL 004试验是一项开放标签、单臂、多中心的临床1/2期试验。数据分析显示试验达成主要终点,20%接受Breyanzi治疗的复发或难治性CLL或SLL患者患者达到完全缓解(CR),安全性已确认。
Orchard Therapeutics:Lenmeldy
3月18日,美国FDA批准英国Orchard Therapeutics公司的基因疗法Lenmeldy,用于治疗异染性脑白质营养不良(MLD)儿童患者。该药定价425万美元,折合人民币约3060万元,超过Hemgenix(350万美元)跃升为有史以来最昂贵的药物,再次刷新了“天价药”纪录。
MLD由芳基硫酸酯酶-a(ARSA)基因突变引起,导致硫酸盐在大脑和身体其他区域,如肝脏、胆囊、肾脏、脾脏蓄积。随着时间的推移,患者的神经系统会受损,导致运动、行为和认知退化,并出现严重痉挛和癫痫发作等现象。患者会逐渐丧失活动、说话、吞咽、进食等能力。
Lenmeldy使用慢病毒载体将编码芳基硫酸酯酶-A的ARSA转基因导入从MLD患者自身搜集来的CD34阳性造血干细胞中,以恢复芳基硫酸酯酶-A的表达,再将造血干细胞回输患者体内,达到一次性治疗疾病的效果。

辉瑞:BEQVEZ
4月26日,Pfizer(辉瑞)宣布美国FDA已批准其一种基于腺相关病毒(AAV)载体的基因疗法BEQVEZ (fidanacogene elaparvovec-DZKT)上市,用于治疗中度至重度血友病B且对AAV血清型Rh74的中和抗体检测为阴性的成年(18岁及以上)患者。据悉,BEQVEZ的定价为350万美元,与之前获批上市的由UniQure公司开发的B型血友病基因疗法Hemgenix价格一致。
此前,加拿大卫生部已于2024年1月3日批准Beqvez在加拿大上市。
BEQVEZ是一种体内基因治疗药物,利用基因工程改造的AAV衣壳提高了将高活性人类FIX基因递送到人体目标组织器官的能力,Beqvez旨在使患者能够自行产生足够的FIX蛋白,从而无需定期接受FIX输注,进而改善患者的凝血功能。给药方式为静脉输注,一次给药长期甚至终生有效。
总结
CGT领域是天价药频繁出现的领域之一,今年Orchard Therapeutics的Lenmeldy和辉瑞的Beqvez获批上市后,冲击了最贵药物排行榜单,分别占据第一位和并列第二位。
展望未来,更具潜力的细胞与基因疗法正在不断发展和多样化,无论是从治疗理念、全球推进,以及国家层面的重视程度来看,CGT领域无疑是一项有长期技术突破需求的领域,因而还需要进一步的研究和实践,以解决其中的挑战和难题,确保细胞和基因疗法的安全性和有效性。
2024年还有7款CGT疗法有望成功闯关获批上市,包括:恒润达生的CAR-T细胞治疗产品润达基奥仑赛注射液、Adaptimmune Therapeutics的工程化T细胞疗法艾基奥仑赛、BioCardia的CardiAMP、辉瑞的新型研究性基因疗法Fidanacogene elaparvovec、Rocket Pharmaceuticals的基因疗法Kresladi、Autolus Therapeutics的CAR-T细胞疗法Obecabtagene autoleucel、Abeona Therapeutics的在研自体细胞疗法Prademagene zamikeracel (pz-cel)。