
细胞和基因治疗(CGT)作为创新医疗技术的代表,正逐渐从实验室走向临床应用,为患者带来新的希望,中国在这一领域发展迅猛。2024年5月20 日,药品审评中心(CDE)发布了《中国新药注册临床试验进展年度报告(2023年)》。今天,我们带您了解报告中关于CGT的亮点内容。
1. 细胞和基因治疗产品类临床试验情况
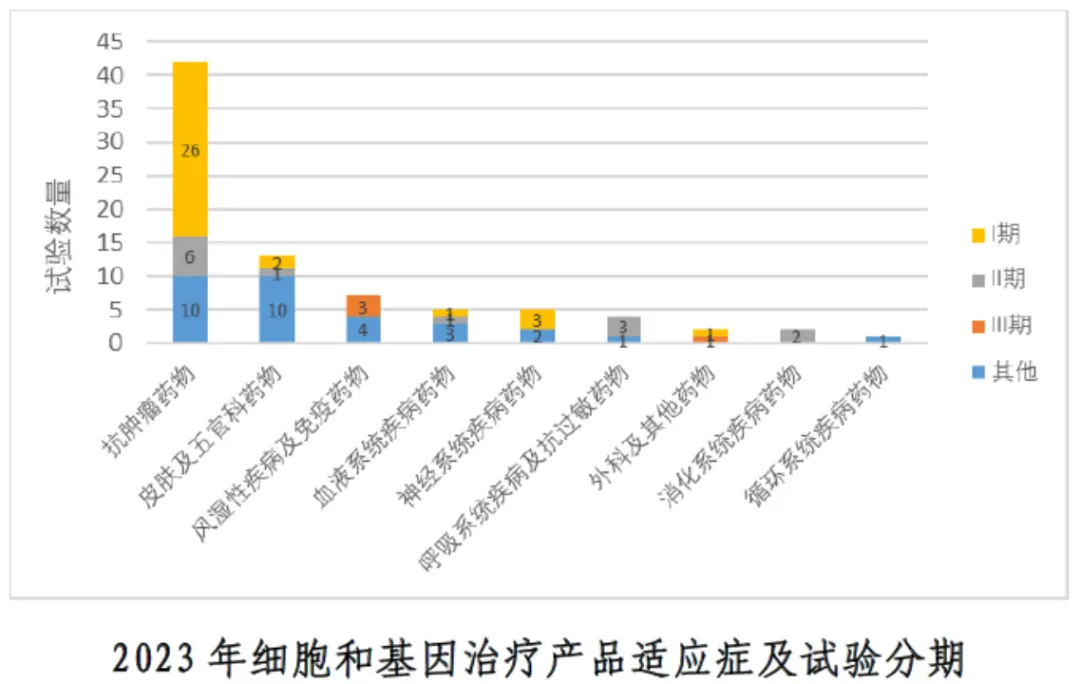
①临床试验数量增长:2023年共登记81项细胞和基因治疗产品类临床试验,较2022年的46项增长近1倍。②品种数量:81项试验共涉及70个品种。③试验范围:以国内临床试验为主,共76项(占93.8%)。④适应症分布:适应症以抗肿瘤药物为主,共42项(占51.9%)。⑤试验分期:üⅠ期临床试验为主,共33项(占40.7%)。üⅢ期临床试验占比较小,仅为4项(占4.9%)。
2. 细胞和基因治疗产品类临床试验的具体数据
①2023年细胞和基因治疗产品适应症及试验范围分布:展示了适应症和试验范围的具体分布情况,其中国内试验为主。

②2023年细胞和基因治疗产品适应症及试验分期:提供了试验分期的分布情况,其中Ⅰ期临床试验占主导地位。
总体趋势
增长趋势:细胞和基因治疗产品类临床试验数量呈现显著增长,反映出该领域的活跃度和研发投入的增加。
研发重点:抗肿瘤药物作为主要的适应症领域,显示了细胞和基因治疗在治疗肿瘤方面的潜力和关注度。
临床试验阶段:大多数试验集中在早期阶段,尤其是Ⅰ期,这可能表明许多细胞和基因治疗产品仍处于研发的早期阶段。
结语
2023年,中国在细胞和基因治疗领域的临床试验活动显著增加,显示出国内对于这一前沿医疗技术的高度兴趣和投入。随着临床试验数量的增长和适应症领域的扩展,相信未来几年这一领域将会有更多突破和进展。同时,国内临床试验的主导地位也表明了中国在全球细胞和基因治疗研究中的重要角色。
参考:CDE-中国新药注册临床试验进展年度报告 (2023年)