
大规模生产诱导多能干细胞 (iPSC) 对于治疗多种临床适应症至关重要。然而,培养足够的iPSC用于临床应用存在不小的挑战,包括它们敏感的多能状态以及对支持基质的依赖。开发可放大且满足临床需求的干细胞生物工艺策略需要结合能够实时监测细胞分化状态、生长状态和活性的内在标志物的方法。此外,适当的细胞培养模式,从而以悬浮状态支持高质量的悬浮干细胞生长是工业化规模的关键。在本文中,我们将介绍细胞培养基、悬浮模式和监测技术的概况,这些技术可以在诱导、扩增和生产过程中保持iPSC的质量和多能性。
干细胞生产的最新进展以及挑战
涉及干细胞的细胞疗法 (如组织移植或药物发现) 被用于治疗各种临床适应症,主要用于肿瘤、心脏病、免疫和神经疾病领域。因此,干细胞研究领域的一个主要焦点是在保持细胞分化控制的同时,推进细胞生长策略。传统上,胚胎干细胞 (ESC) 是细胞治疗的理想细胞类型,因为其固有的多能性,即细胞分化成任何特化细胞类型的能力。这些细胞的发现为再生医学和各种病理疾病的治疗提供了巨大的机会。无论干细胞来源如何,ESC在增殖过程中必须经历自我更新,以维持多能性,在此过程中,向特定细胞类型的分化受到抑制。
2007年,Yamanaka及其同事领导了干细胞领域的重大技术突破,成功地将人类体细胞转化为与人类ESC (hESC) 具有相似基因表达谱和多能性的干细胞。这些细胞被称为人类iPSC (hiPSC)。通过避免使用胚胎提取干细胞来解决伦理问题,iPSC是一个更有利的研究和临床应用平台。鉴于其固有的自我更新能力、多能性和相对较低的免疫原性,iPSC代表了一种极有前景的、无限的患者来源细胞,用于人类遗传疾病建模和毒理研究,这降低了药物开发和临床试验的总体成本和相关风险。由于其多方面的能力,iPSC技术仍然是个性化细胞治疗和再生医学的一个有前途的科学工具。
目前的临床细胞治疗和人类组织再生需要10^8-10^10的临床级干细胞,并遵循现行良好生产规范 (cGMP)工艺培养。然而,由于依赖于支持基质以及多能干细胞敏感的多能状态,细胞培养放大到必要的程度仍然是一个重大挑战。收获过程中iPSC的最终质量取决于细胞的代谢状态;更具体地说,维持多能状态和自我更新对于生产临床级iPSC至关重要。因此,监测细胞分化状态、生长状态和活性的内在标记的方法对大规模生产最有用。此外,现有平台正在进行优化,以满足cGMP标准,以便有效地将生物工艺放大到临床生产环境。在本文中,我们将强调iPSC细胞培养方法的最新进展,包括培养基、悬浮模式和监测技术,这些方法在一定程度上保持了iPSC的质量和多能性,以满足临床生产的需要。此外,我们将还讨论未来有可能提高iPSC生物工艺效率和产量的技术。
从异质细胞群中分离iPSC
很多信号可以激活干细胞分化,因此,细胞培养条件的细微变化或对细胞的应激可导致细胞群的异质性分化。这是一个严重的安全问题,因为分化细胞污染可能在细胞移植受体中引起潜在的肿瘤或畸胎瘤形成。然而,自发的干细胞分化可以在细胞培养过程中发生,如间充质干细胞(MSC)在细胞外基质中延长培养时所观察到的。调节这种类型的反应并保存用于未来应用的PSC,分离多能细胞和分化细胞的细胞分选方法已经得到应用。荧光活化细胞分选 (FACS) 和微孔粘附是流行的高通量方法,用于基于定义的多能性特征分离细胞,多能性标记阳性干细胞的选择性通过细胞培养条件得到增强。对于iPSC,当添加四种抑制剂的小分子混合物 (SMC4培养基) 时,分选后观察到SSEA4/ tra181阳性iPSC克隆比在传统重编程培养基中分选的细胞衍生克隆增加55倍。尽管FACS是高度自动化和标准化的,但分选单个细胞、以产生稳定的多能细胞克隆仍然是一项劳动密集型且耗时的工作。因此,能够产生多能细胞群体作为池培养的方法是首选的,因为池可以保持多能标记物的长期稳定表达。为此,使用细胞表面标记抗体的磁激活细胞分选 (MACS) 方法已被用于生成iPSCs池。在这种情况下,用TRA-1-60和SSEA4抗体进行一轮异质性细胞池分选后,TRA1-60和SSEA4阳性细胞的数量分别增加了28%和11%。另外几轮的MACS进一步富集了表达多能性标记的细胞群体。一般来说,MACS是比FACS更好的方法,因为它可以轻松快速地同时在多个样品上进行,同时仅对细胞施加较小的剪切应力。
尽管细胞分选方法在基于形态学和表面标志表征干细胞群体方面是有效的,但目前广泛采用细胞分选方法分离动物或临床研究级多能干细胞仍受到阻碍。这主要是由于GMP级抗体的高成本以及临床级FACS仪器和专业知识的有限可用性。因此,在未来的细胞治疗临床试验中,需要可放大的平台来生成可靠、均一且安全的临床级多能干细胞群体。
最佳iPSC培养基及培养基的开发
在扩增过程中控制iPSC质量的关键一步是在生物工艺中使用良好表征的材料,其中细胞培养基和基质起着关键作用。细胞培养基通过提供营养、矿物质和pH的良好平衡,对维持健康、增殖的细胞至关重要。细胞培养基质被用作细胞粘附和增殖的支架,基质通常被饲养层细胞或生长支持因子包裹,以进一步增强细胞的粘附和生长。使用完全表征的细胞培养系统对于控制良好的生物工艺过程至关重要,特别是对于生产临床级生物样品。在过去的十年中,通过考虑有助于维持iPSC细胞系多能性和整体工艺可放大性的信号通路,iPSC培养基配方和基质已经得到显著的发展。
当涉及到为iPSC设计培养基时,一种策略方法是确定多能性依赖的信号转导途径中涉及的内在生长因子。调控干细胞多能性基因水平的途径多种多样,如转化生长因子(TGF)-ß超家族激活级联、受体酪氨酸激酶信号通路 [碱性成纤维细胞生长因子(bFGF)的下游]、涉及胰岛素样生长因子(IGF)的途径等。有趣的是,mESC中足以维持多能性的蛋白质和生长因子 (即骨形态发生蛋白 (BMP) 和白血病抑制因子 (LIF) )不同于hESC。多能干细胞在多能性和自我更新维持方面也可能需要不同的生长因子。例如,bFGF已被确定为维持体外hESC自我更新的关键添加物,在无饲养层培养物中其浓度从40 ng/ml到100 ng/ml不等。与hPSC自我更新有关的还有典型的Wnt/b-catenin信号,虽然单独添加Wnt3a不足以在没有饲养层细胞的情况下维持未分化的hESC。鉴于这些代谢研究是在hESC上进行的,而不是在iPSC上进行的,因此需要对iPSC进行更深入的表征,以设计培养基,并考虑为临床应用而开发的每种新细胞系的独特要求。
通过提供特定干性支持因子以及产生细胞外基质(ECM)富集环境,以饲养层细胞为基础的基质可防止干细胞自发分化,并改善ESC和/或iPSC的附着。支持PSC最常用的饲养层细胞是增殖失活小鼠胚胎成纤维细胞(MEF),因为它们产生多种对多能性维持至关重要的蛋白质,如TGF-β1、激活素A、BMP-4、多营养因子(肝素结合生长因子)等。然而,由于饲养层细胞的增殖能力有限,重复传代后支持iPSC多能性的效率降低,且会导致iPSC分离过程中的高污染风险,在饲养条件下大规模生产iPSC时会出现相关技术挑战。此外,动物源性饲养基质可能增加人畜共患病原体和未知病毒向宿主细胞转移的风险,从而导致免疫系统排斥反应。因此,iPSC培养方法主要侧重于通过使用ECM蛋白、条件培养基或合成生物材料而过渡到无动物成分和无细胞 (称为“无饲养”) 的培养系统。
随着培养基的发展,在过去的十年中,iPSC细胞培养基质逐步达到了cGMP标准。最近的一项iPSC研究表明,长期使用动物源性血清和含xeno分子会影响细胞形态、扩增潜力、基因表达和细胞因子谱。这推动了xeno-free培养基 (XFM) 配方的开发,随后是无动物源性成分 (ACF) 培养基,以支持iPSC扩增。在已开发的ACF培养基类型中,Essential 8TM (Thermo Fisher Scientific)培养基是iPSC培养中使用最多的基础培养基,因为它含有8种干细胞增殖最必需的元素:DMEM/F12、L -抗坏血酸、磷酸镁、硒钠、FGF-2、胰岛素、NaHCO3以及转铁蛋白、TGF-β1或Nodal。
无饲养iPSC扩增方法的发展促进了未来自动化生产的可能性。事实上,使用CompacT SelecTTM细胞培养系统,在无饲养条件下,大规模自动化生产未分化的iPSC是可行的。在这种情况下,使用含有Activin A和FGF-2的化学限定培养基 (CDM) 自动传代的聚体hiPSC可保持其特征形态和多能性标记物的表达。生物材料也被探索作为无饲养iPSC培养系统的增强基质。例如,一项研究发现,基于水凝胶的基质存在最佳弹性 (25 kPa),使细胞保持多能性。进一步的研究表明,接枝到水凝胶 (储存模量为25 kPa) 上的双链体外连接素衍生的寡肽支持hESC和iPSC的长期生长,可超过10代。ECM,如纤维连接蛋白、层粘连蛋白和玻璃体连接蛋白,或来自ECM的寡肽,具有特定的细胞结合结构域,这使得它们成为支持iPSC在无饲养基质系统中生长的重要成分。3D生物打印和细胞/组织打印技术也为未来的工艺放大和自动化解锁了可能性。最近,当iPSC在涂有纤维连接蛋白的无饲养壳聚糖或聚氨酯膜上驯化和扩增时,证明了细胞打印技术的有效性。在这项研究中,嵌入热敏聚氨酯 (PU) 水凝胶基质的iPSC显示出更高的活性。然而,进一步优化基于聚合物的无饲养基质是必要的,因为PU水凝胶培养的多能性标记 (即OCT4和NANOG) 与对照MEF饲养层培养不同。
细胞培养动力学不仅决定了iPSC的最终行为,而且决定了整个生物工艺的成本。尽管在具有监测和反馈控制pH值和溶氧 (DO) 能力的一次性多层培养器皿中已经证明了在2D静态培养中大规模生长hPSC的可行性,但在2D或3D静态基质上大规模生产hPSC仍然是一种成本、劳动力和空间密集的方法。已知静态培养条件也会导致培养基成分、代谢废物、旁分泌因子和气体的不利梯度。主要的共识是,动态悬浮培养是实现临床应用所需的多能干细胞密度的最佳方法,目前正在积极开发高效且可放大的悬浮多能干细胞扩增的新策略。例如,可以利用成功的、基于基质的研究来设计最佳悬浮培养模式。
iPSC悬浮方式的关键考虑因素 (聚集体、微载体和微胶囊)
无基质的iPSC悬浮培养系统克服了静态基质可放大性有限的挑战,同时支持iPSC生长和多能状态。由于iPSC的贴壁性质,当它们在悬浮体系中接种和扩增时,3D聚集体 (或球体) 会自发形成。iPSC聚集体与胚状体 (EB) 非常相似,因此可以作为扩增后直接谱系分化的一种有用方式。iPSC聚集体的生长和多能性主要取决于微环境、聚集体大小分布和细胞培养罐大小。有研究对培养条件进行了优化,使hiPSC在转瓶的E8TM无饲养条件下,以未分化悬浮细胞聚集体扩增,超过10代。从那时起,搅拌悬浮培养已扩大到3000 ml的一次性生物反应器 (1000ml工作体积),以产生大量的hiPSC聚集体 (多达2x10^9个细胞),同时保留多能状态标记物的表达,包括TRA-1-81、SSEA-4、OCT4和SOX2。
然而,在动态悬浮培养中扩增iPsc聚集体存在局限性。与静态悬浮培养相比,扩增率降低,聚集体大小形成不均一。如果不加以控制,细胞大团块 (>800 um) 的形成会导致细胞活性、自发分化、营养和氧气扩散梯度,以及整体扩增过程减慢。通过优化搅拌桨类型和搅拌速度,可以控制iPSC培养中的聚集体尺寸。新型生物反应器系统的一个例子是垂直轮生物反应器(VWBR),可在扩增iPSC的同时降低聚集体的大小,其中,搅拌由垂直叶轮提供,因此可以实现容器的高效均质化。使用该系统,在保持多能性的同时,产生了平均直径为350 um的聚集体 (最高密度2.3x10^6 cells/ml)。
培养基添加物也会影响聚集体的形成。例如,在hiPSC聚集体扩增过程中,短期使用维甲酸 (RA) 处理可进一步维持多能性。类维生素A通过增加多能依赖性转录因子(Nanog和Oct4)的表达和激活磷脂酰肌醇-3激酶(PI3K)信号通路来支持iPSC自我更新。此外,化学限定培养基中添加Rho相关的卷曲螺旋激酶 (ROCK) 抑制剂Y27632可以促进多种悬浮罐类型中从单细胞接种开始iPSC聚集体的形成。卷曲螺旋激酶抑制剂通过减少解离诱导的细胞凋亡和提高克隆效率来支持干细胞聚集体的存活。然而,最近的研究表明,长期暴露于ROCK抑制剂会改变iPSC的代谢。因此,培养基添加、接种策略和生物反应器设置是优化提高生物工艺产量的关键参数。通过进一步优化,可以实现足够临床应用的iPSC聚集体的大规模生产。在这种模式下,营养物质的运输机制和聚集体的大小分布都需要改进,以保持高密度下细胞聚集体的多能性和活力。
微载体
在生物反应器系统中加强干细胞培养扩增的工作已经在微载体的实施方面取得了进展。微载体的优点是提供了一个表面积来支持PSC的生长和附着,同时保持了动态悬浮培养系统的优势。微载体可以用于细胞种子制备,如果是可生物降解的,也可以在治疗过程中最终用于将细胞运送到所需的受损组织。各种生物可降解材料通常被用于生产针对细胞系扩增的微载体,包括葡聚糖、胶原蛋白、明胶、聚乳酸-羟基乙酸(PLGA)、聚l-乳酸(PLLA)、聚苯乙烯(PS)和羟基磷灰石(HA)。与较大的静态基质类似,微载体通过其表面电荷的适当联系,以及当被ECM蛋白(如玻璃体连接蛋白、纤维连接蛋白和层粘连蛋白)包裹时,为PSC的生长提供进一步增强的支持,搅拌微载体培养系统已被证明可以促进贴壁依赖性干细胞的扩增和规模放大,同时为监测和控制干细胞健康和分化提供必要的工具。通过增强氧气供应和代谢物质量运输以及降低微环境毒性来提高PSC的产量。
然而,在使用微载体扩增hiPSC时,需要考虑一些问题。微载体的限制取决于它们的直径(100- 400um)、密度(通常为-1 g/ml)和化学成分,它们会影响细胞附着,从而影响扩增能力。由于微球的表面积有限,hiPSC的峰值密度似乎受到微球与细胞比例的限制。粘附在微载体微球上的细胞也需要酶解和过滤,这可能会牺牲细胞的活力和多能性,具体取决于所使用的方法。为了缓解这一问题,生物可降解微载体正在开发中。与传统的PS微载体相比,无异源可溶微载体的开发最近取得了不小的进展,使转瓶中的细胞回收率大大提高。
搅拌式生物反应器还会对微载体微球施加流体动力剪切应力,从而影响hiPSC的整体健康和多能性。这可以通过优化生物反应器工艺参数 (即搅拌速率) 来克服,以尽量减少剪切应力对iPSC的影响。例如,Gupta及其同事证明,在转瓶中,iPSC在微载体上的长期附着、多能性和扩增依赖于保持25 RPM的最佳搅拌速度。这种参数优化方法需要应用于更大规模的iPSC扩增 (即生物反应器)。
制造微载体微球的成本是另一个需要考虑的问题,因为根据所使用的材料和添加剂,该工艺可能会变得异常昂贵。因此,重要的是微载体材料具有成本效益,如果可能的话 - 可回收,并且在每次生产运行后可消毒。使用控制良好的生物工艺系统,基于微载体的iPSC培养方法正在开发中,用于细胞治疗和组织工程中人类iPSC的持续扩增和回收。
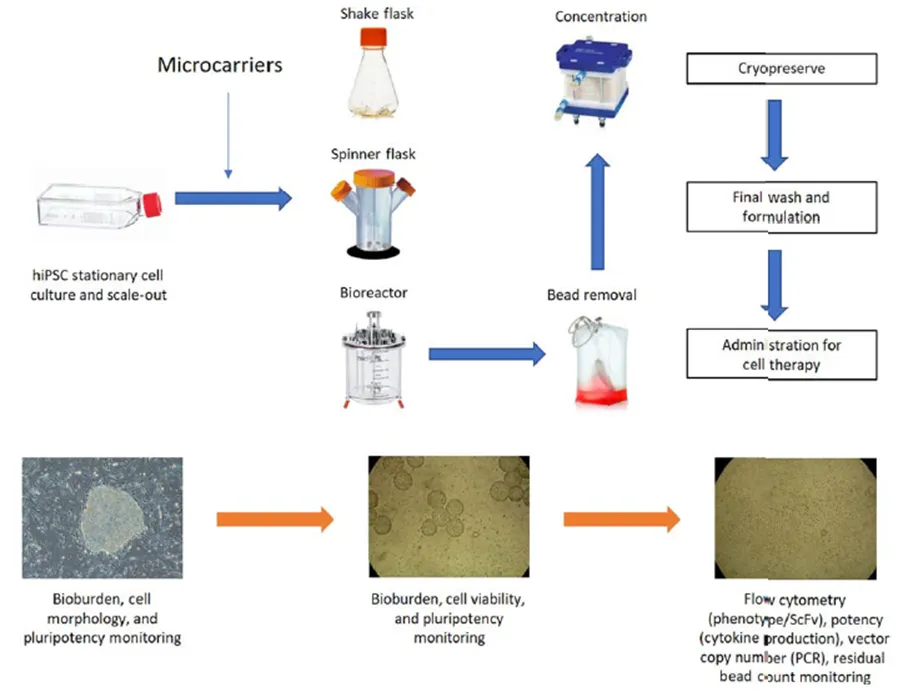
利用微载体制备人诱导多能干细胞 (hiPSC) 的生物工艺研究进展,典型工艺包括静态培养、放大工艺、下游工艺和制剂,微载体通常在放大过程中引入,在下游工艺过程中去除。
微胶囊化
微胶囊与将细胞附着在微球表面的微载体不同,微胶囊化涉及将细胞捕获在球形胶囊内,细胞生长所需的营养物质、氧气和其它生长因子可以通过球形胶囊扩散。球形胶囊由半透性材料或膜组成,在悬浮培养系统中可以保护细胞免受聚团和剪切力的影响。用于生成微胶囊的生物材料包括海藻酸盐、琼脂糖、尼龙、胶体、聚苯乙烯、丙烯酸酯、聚赖氨酸-海藻酸盐水凝胶、醋酸纤维素-乙基纤维素和聚酯膜。通常通过乳化或挤压方法捕获细胞,形成保护管,使细胞增殖。总的来说,聚合物微胶囊与凝胶微胶囊相比具有一定的优势,包括生物相容性和GMP相容性。每单位体积的胶囊材料可以容纳更多的细胞,并且由于在胶囊内空间存在液体细胞悬浮液,聚合物胶囊中的颗粒间扩散限制不那么严重。
在微胶囊系统中培养的干细胞既可以维持多能性,也可以被诱导分化,这取决于其胶囊的组成和微环境中存在的生长因子。微胶囊化技术在大规模生产中所面临的缺点与微载体类似,即制造成本和有限的表面积。此外,一些干细胞类型,如hMSC,在没有添加肽或蛋白质(如纤连蛋白)的情况下被包裹时 (例如,在海藻酸盐中) 增殖困难,前者可改善细胞附着。相比之下,如果细胞附着增强,在收获过程中回收被包裹的细胞可能会带来更困难的挑战。
原文:A.Polanco, B.Kuang, S.Yoon, Bioprocess Technologies that Preserve the Quality of iPSCs. Trends in Biotechnology, 2020.