
在全球范围内,间充质干细胞药物的临床研发阶段已经取得了显著进展。据统计,已有655个间充质干细胞药物进入了临床研发阶段,遥遥领先于其他类型的干细胞疗法。
随着艾米迈托赛注射液的获批,标志着我国首款间充质干细胞治疗药物问世。目前,全球获批上市的间充质干细胞治疗药品已有17款,其中10款来源于骨髓,3款来源于脐带,2款来源于脂肪,1款来源于脐带血,1款来源于自体角膜缘。
艾米迈托赛注射液
批准国家:中国
批准日期:2025年1月2日
细胞类型:脐带间充质干细胞
适应症:用于治疗14岁以上消化道受累为主的激素治疗失败的急性移植物抗宿主病(aGVHD)
价格:尚未公开
艾米迈托赛注射液利用人脐带间充质干细胞,通过免疫调节和组织修复功能发挥作用。其作用机制包括抑制免疫细胞的过度激活、调节免疫细胞功能、分化为特定细胞类型以及分泌多种生物活性因子。
该注射液的研发始于2013年,当年首次提交新药临床研究申请(IND),并于2020年6月首次公示临床试验。2024年6月,该药物被纳入优先审评审批名单,并于同月提交了新药上市申请(NDA)。
II期临床试验结果显示,该药物在治疗激素耐药的急性移植物抗宿主病患者中表现出良好的疗效和安全性。临床试验中未观察到与试验药物相关的重要安全性风险。
Ryoncil
批准国家:美国
批准日期:2024年12月18日
细胞类型:同种异体骨髓间充质基质细胞
适应症:用于治疗2个月及以上儿童的类固醇难治性急性移植物抗宿主病(SR-aGVHD)
价格:尚未公开
剂量:通常8次。每次静脉输注2X10^6MSC/kg,每周两次,连续4周,共输注8次。输注至少间隔3天。
Akuugo
批准国家:日本
批准日期:2024年7月31日(获得条件性和时间限制的批准)
细胞类型:骨髓间充质干细胞
适应症:改善创伤性脑损伤(TBI)引起的慢性运动瘫痪
价格:尚未公开
AKUUGO是一种同种异体间充质干细胞产品,通过将人Notch-1胞内结构域基因暂时转染到培养细胞中,增强了再生神经细胞的能力,是全球首款获批用于创伤性脑损伤(TBI)相关慢性运动瘫痪的同种异体细胞治疗药物。研究结果表明,AKUUGO不仅具有神经保护作用,还能促进血管生成并发挥免疫调节功能。
Vartocell
批准国家:伊朗
批准日期:2020年
细胞类型:脐带间充质干细胞
适应症:脑瘫
价格:1亿伊朗里亚尔(每瓶含2000万个细胞)约2300美元
Vartocell是由伊朗Cell Tech Pharmed公司开发的一种脐带间充质干细胞产品,主要用于治疗脑瘫。该产品在2020年获得伊朗的批准,成为全球首款针对脑瘫的干细胞治疗药物。
Stemirac
批准国家:日本
批准日期:2018年11月21日(获得条件性和时间限制的批准)
细胞类型:自体骨髓间充质干细胞
适应症:用于改善脊髓损伤相关的神经功能障碍
价格:约1500万日元/剂(约合9.5万美元)
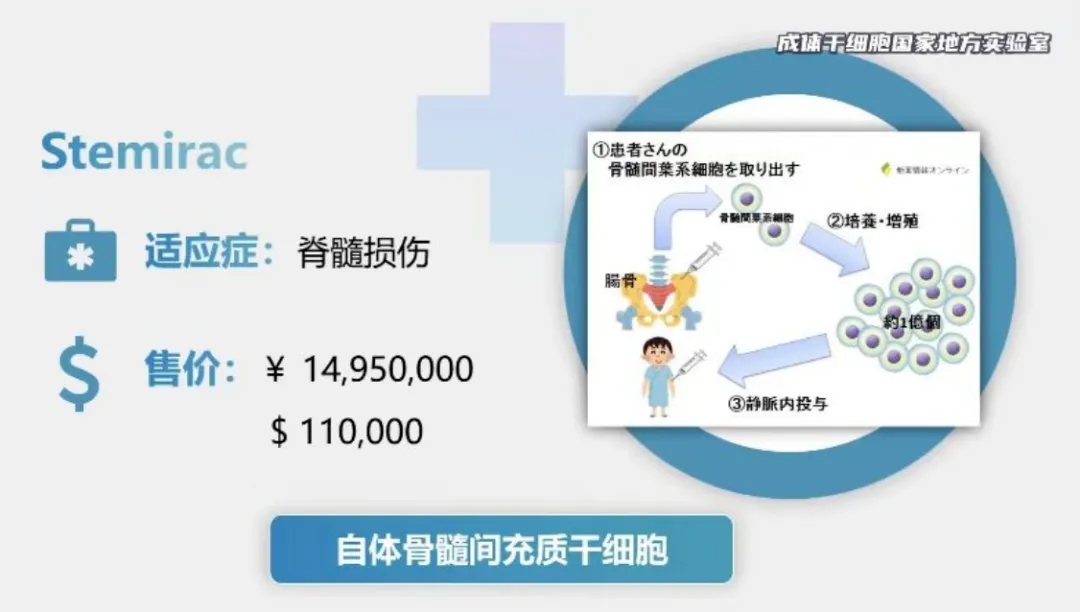
Stemirac的主要成分是从患者骨髓液中提取的间充质干细胞,这些细胞经过体外培养后被悬浮在含有患者自身血清的冷冻保存液中,并进行冷冻保存。主要通过静脉滴注给药。在一项日本的II期临床试验中,Stemirac显示出改善脊髓损伤患者神经功能的效果,并且安全性可接受。
Alofisel
批准单位:欧盟(2024年12月已撤市)、日本
批准日期:2018年3月23日(欧盟批准);2021年9月(日本批准)
细胞类型:脂肪间充质干细胞
适应症:用于治疗克罗恩病(CD)成人患者的复杂性肛瘘
价格:562万日元/剂(约3.6万美元)
疗程:6ml/瓶,单次治疗剂量1.2x10^8个/24ml (共4瓶)

Alofisel 的批准基于关键性III期临床研究ADMIRE-CD的积极数据,该研究显示Alofisel在治疗复杂性肛瘘方面具有显著疗效。但2024年12月,欧盟决定撤回Alofisel的市场授权,原因是未能提供足够的数据以确认其疗效。
Mesestrocell
批准国家:伊朗
批准日期:2018年
细胞类型:骨髓间充质干细胞
适应症:用于治疗骨关节炎
价格:2亿伊朗里亚尔(约4600美元)
剂量:关节内注射2x10^7个细胞/单膝;4x10^7个细胞/双膝
StemSin
批准国家:伊朗
批准日期:2018年
细胞类型:骨髓间充质干细胞
适应症:用于治疗多发性硬化症
价格:未公开
AlloStemSin
批准国家:伊朗
批准日期:2018年
细胞类型:脐带间充质干细胞
适应症:用于治疗肌萎缩侧索硬化症(ALS)
价格:未公开
Temcell
批准国家:日本
批准日期:2015年9月
细胞类型:骨髓间充质干细胞
适应症:用于治疗急性移植物抗宿主病(GvHD)
价格:868,680日元(约合7,700美元)/袋。一个标准疗程每周2袋,共4周8袋。成年患者通常需要2-3个疗程,即平均需要接受至少16袋或最多24袋。因此总费用约合12.3万美元到18.5万美元。

Temcell是由Mesoblast公司开发,由日本JCR制药公司销售,是世界上第一个治疗急性移植物抗宿主病(aGVHD)的间充质干细胞产品。
Stempeucel
批准单位:欧盟、印度
批准日期:2015年6月(欧盟获得孤儿药地位);2020年8月(印度批准);
细胞类型:骨髓间充质干细胞
适应症:用于治疗严重肢体缺血(CLI),包括伯格氏病(Buerger's Disease)和动脉粥样硬化性周围动脉疾病引起的CLI
价格:2200美元(2017年)

Holoclar
批准单位:欧盟
批准日期:2015年2月
细胞类型:自体角膜缘干细胞
适应症:用于治疗因物理或化学因素造成的中至重度角膜缘干细胞缺乏症(LSCD),特别是由眼部灼伤导致的单侧或双侧角膜缘干细胞缺乏症
价格:未公开,但据相关报道,每只眼睛的治疗费用约为80,000美元。
Holoclar是由意大利凯西制药(Chiesi Farmaceutici)研发的首个含干细胞的先进治疗产品,也是首个用于治疗角膜缘干细胞缺乏症(LSCD)的产品。该疗法通过离体扩增的自体人角膜上皮细胞(包含干细胞)来修复受损的角膜细胞,能够改善或解决疼痛、畏光等症状,并可改善患者的视敏度。
NeuroNATA-R
批准国家:韩国
批准日期:2014年7月30日
细胞类型:自体骨髓间充质干细胞
适应症:用于治疗肌萎缩侧索硬化症(ALS)和其他运动神经元病
价格:根据患者的体重而有所不同,大约在1.8万至7.2万美元之间
剂量:通常每4周进行两次注射

NeuroNATA-R是世界上第一个基于干细胞的肌萎缩侧索硬化症(ALS)疗法,由韩国Corestem公司开发。该疗法通过注射自体骨髓间充质干细胞,具有神经保护作用,可以延缓运动神经元的死亡,从而减缓ALS的进展。在临床试验中,NeuroNATA-R显示出良好的安全性和一定的疗效。
Prochymal
批准国家:加拿大、新西兰(2016年已从新西兰撤市)
批准日期:2012年5月17日
细胞类型:骨髓间充质干细胞
适应症:用于治疗儿童急性移植物抗宿主病(GvHD)
价格:20万美元/疗程(通常4剂)
Prochymal是由Osiris Therapeutics公司开发的全球首个获批上市的异体骨髓间充质干细胞治疗药物。
2012年5月17日,Prochymal 获得加拿大卫生部批准,用于治疗儿童急性移植物抗宿主病(GvHD)。
2012年,Prochymal在新西兰获得批准,但于2016年从新西兰撤市。
2013年,Mesoblast公司从Osiris Therapeutics收购了Prochymal,并将其更名为Remestemcel-L。
2016年,Remestemcel-L在日本获批上市,商品名Temcell。
2024年12月,美国FDA批准了基于Prochymal的Ryoncil (remestemcel-L)上市,用于治疗2个月及以上儿童患者的类固醇难治性急性移植物抗宿主病(SR-aGVHD)。
Cupistem
批准国家:韩国
批准日期:2012年1月
细胞类型:自体脂肪间充质干细胞
适应症:用于治疗克罗恩病的复杂性肛瘘
价格:约600万韩元(约5000美元/次)
Cupistem于2014年获得了韩国健康保险审查与评估服务(HIRA)的医疗保险价格批准。
Cartistem
批准国家:韩国
批准日期:2012年1月
细胞类型:脐带血间充质干细胞
适应症:用于治疗退行性关节炎和膝关节软骨损伤
价格:1.9-2.1万美元

脐带血间充质干细胞在损伤软骨微环境中损伤因子的刺激下,能够分泌生长因子、细胞因子以及配体等复杂基质,促进软骨分化、调节炎症反应、抑制软骨分解蛋白活性、诱导软骨再生。
自2012年上市以来,Cartistem的手术例数稳定增长,2012年首年实施228例手术,到2015年实施1237例手术,手术例数增长5倍。截至2024年,接受Cartistem治疗的患者累计人数已经超过30000人。
CellGram
批准国家:韩国
批准日期:2011年7月1日
细胞类型:自体骨髓间充质干细胞
适应症:用于治疗急性心肌梗死(AMI)
价格:1800万韩元(约合15,000美元),不在医保报销范围内
2018年,CellGram的销售额达到25亿韩元的峰值,随后开始下降,2023年为8亿韩元。
CellGram上市时需在6年内提供600名患者的临床数据。Pharmicell后来申请将数量减至60人但被拒绝。这一情况引发了行业对其未来批准状态的关注。
随着对间充质干细胞疗法机制的深入研究以及新适应症的不断开发,这种创新疗法有望为更多患者带来新的希望。与此同时,科学家们正致力于探索更有效的给药方式和优化治疗方案,以进一步提升治疗效果并最大限度地降低潜在副作用。我们有理由相信,在不远的将来,间充质干细胞疗法将在更多疾病领域展现其独特的价值和巨大潜力,为全球医疗健康事业带来深远影响。