
来源:南开细胞工程
摘要:Ⅰ型糖尿病(T1D)是由于患者对β胰岛细胞存在先天性和特异性免疫反应产生破坏而引起的一种慢性自身免疫性疾病。胰岛移植是调节T1D患者血浆葡萄糖的一种治疗方法。然而胰岛移植手术由于供体可用性低、胰岛丢失率高和免疫排斥而受到限制,亟须开发新技术来提高胰岛的植入效率和存活率,并保持胰岛的功能。间充质干细胞(MSCs)是具有高可塑性的多能非造血祖细胞,可以在体内和体外保证胰岛细胞发挥功能。在胰岛移植中,胰岛与MSCs的共同移植在比单独胰岛移植更有效。此外,MSCs在控制移植物排斥反应方面也有一定潜力。MSCs有益于血管生成、抑制免疫反应和分泌胰岛存活和发挥功能所必需的生长因子,并且可以通过直接的细胞间接触或通过其分泌组(包括外泌体)与先天性和适应性免疫系统细胞相互作用,从而对胰岛细胞移植产生积极作用。在本文中,我们描述了间充质干细胞与胰岛功能和糖尿病相关的多个方面,讨论了目前间充质干细胞作为能够控制免疫系统以防止排斥反应和促进内源性修复的细胞管理者的关键作用。
关键词:胰岛细胞移植;Ⅰ型糖尿病;间充质干细胞
1 引言
Ⅰ型糖尿病(type 1 diabetes,T1D)或青少年糖尿病是一种慢性自身免疫性疾病,其产生原因是内分泌胰腺中产生胰岛素的β细胞逐渐被免疫细胞破坏。T1D的特征是胰岛的慢性炎症和免疫细胞浸润,称为胰岛素炎。低血糖和高血糖均可导致健康并发症。因此T1D患者需要皮下注射外援胰岛素来维持正常的血糖水平。胰岛移植或全胰腺移植的治疗方法也被应用于治疗T1D,但这些治疗方法需要随后进行免疫抑制治疗。由于移植引发的急性炎症反应和促炎细胞因子IL-1β、TNF-α和IFN-γ的释放,使得高达80%的移植胰岛在整合到组织中之前丢失。同种异体免疫移植物排斥反应和自身免疫复发也对胰岛移植的成功提出了挑战。此外,有限的组织供应也是胰岛移植手术的一个难题。
间充质干细胞(MSCs) 是存在于各种组织中的多能非造血祖细胞,包括骨髓、脂肪组织、肝脏和脐带血。它们可以分化成多种细胞类型,包括骨细胞、脂肪细胞、软骨细胞、内皮细胞和肌细胞。MSC的低免疫原性以及免疫抑制特性使MSCs成为治疗包括T1D在内的各种自身免疫性疾病的有前途的治疗工具。多项研究表明,间充质干细胞可以通过调节免疫、促进血管生成,减弱胰岛移植后的免疫应答并提高胰岛移植效率。本文将介绍间充质干细胞对β细胞功能的有益作用。
2 胰岛移植治疗Ⅰ型糖尿病
2000 年,Shapiro 等人制定了胰岛细胞移植的埃德蒙顿方案[16]并引入了无糖皮质激素的免疫抑制方案,突破了T1D传统治疗手段,并为彻底治愈T1D带来希望。2006年,Shapiro等人发表了在世界范围36个地区接受他们的胰岛细胞移植治疗的28例患者的随访结果。根据埃德蒙顿方案,Shapiro 等人将胰岛细胞从已故供体中分离,通过门静脉注射的方法移植到患者体内。在参与的患者中,58%的患者在研究的某些时候尽管处于良好的血糖控制下仍具有胰岛素依赖性,76%的患者在移植2年后需要一定程度的胰岛素治疗。另外,这项研究说明了免疫抑制药物对胰岛细胞功能的破坏作用,并促进了后续对单药免疫抑制的研究。免疫抑制药物在肝门静脉部位的毒性很大,因此进一步研究胰岛的替代移植部位十分重要。
2022年,Marfil-Garza等人发表了加拿大埃德蒙顿阿尔伯塔大学20年的胰岛细胞移植研究结果,这项仅埃德蒙顿就有255名患者参与的研究是胰岛移植后长期结果的最大队列研究。尽管存在慢性免疫抑制,这项研究仍说明了胰岛细胞移植的长期安全性。在7.4年的跟随观察中,90%的患者保持存活,其胰岛移植物的生存时间中位数为5.9年。与非持续移植物存活的患者相比,具有持续移植物存活率的患者表现出更好的胰岛素独立性和更好的持续血糖控制情况。
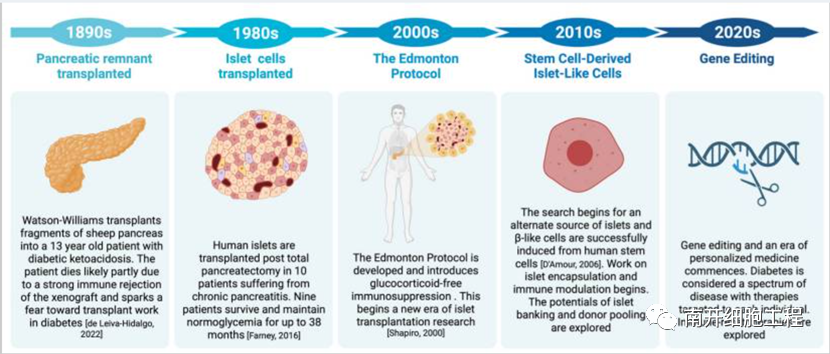
图1 1890年至今同种异体胰岛细胞移植的演变
3 间充质干细胞
间充质干细胞(multipotent stromal cells, MSC)是细胞治疗中在生理和病理条件下维持体内平衡的细胞来源。与其他干细胞不同,MSC的使用不存在伦理问题。此外,在临床前动物疾病模型中已知的MSC治疗潜力已经在临床试验中得到了初步验证。
间充质干细胞可以从多种不同的生物组织中分离得到,如成人骨髓(BM)、脂肪组织以及产前组织(如脐带和胎盘),并且具有广泛增殖、多能性和归巢/迁移的特点。Friedenstein首次在小鼠BM中分离出MSC,它们在体外和体内都显示出免疫抑制功能。此外,Davies及其同事测试了输注自体MSC(来自宿主糖尿病患者)或来自健康供体的同种异体MSC的差异,并证明两组之间在免疫抑制活性、血液相容性或迁移能力方面没有功能差异。有证据表明,间充质干细胞分泌组发挥旁分泌作用,在急性胰腺炎中起保护作用。
间充质干细胞已被证明可以改善多种自体免疫介导的疾病,包括移植物排斥反应、移植物抗宿主病、类风湿性关节炎、系统性狼疮性红斑病。此外,间充质干细胞可以促进伤口愈合和组织再生。在各种环境中,人间充质干细胞已被证明对糖尿病有益。越来越多的证据表明,间充质干细胞对产生胰岛素的β细胞和胰岛存活率具有积极作用,胰岛与间充质干细胞共移植可增加胰岛移植物的存活率。MSC移植的优点是患者耐受性良好,无明显毒性,但偶尔也有一些不良反应,如胃肠道和皮肤疾病。间充质干细胞移植后,这些细胞可以通过分化成各种细胞表型,提供细胞因子、趋化因子、生长因子和其他生物活性因子,增强干细胞和组织祖细胞的增殖并抑制免疫反应,从而成为为受损组织提供修复环境并促进组织再生。
4 间充质干细胞对胰岛功能的保护
体外培养人胰岛会导致功能丧失、去分化、衰老、细胞凋亡和坏死。从体内分离胰岛细胞还有一定概率导致其死亡。在分离3-6天后对人胰岛进行单细胞转录分析,发现胰岛素阳性细胞β细胞基因表达降低,伴有祖细胞标志物水平升高,表明离体胰岛细胞已经发生了早期的去分化。因此,需要开发适当的培养条件来维持胰岛功能,用于体外研究和胰岛移植前的胰岛保存。几项研究表明,胰岛与间充质干细胞共培养可以在胰岛细胞离体及体外培养中保持其功能活性。实验结果表明,间充质干细胞提供了维持β细胞功能和存活的因子,并抑制了胰岛细胞离体后自发性的去分化。
Yeung等观察到,人间充质干细胞通过分泌金属蛋白酶2和9保护人胰岛细胞免受促炎细胞因子IFN-γ、TNF-α和IL-1β的破坏。已有实验证明,MMP-2和MMP-9通过降低T细胞表面的IL-2R(CD25)表达来促进MSC的免疫抑制功能。敲除MMP-9的小鼠体内胰腺和胰岛发育正常,但应对高血糖的反应通路受损,即MMP-9敲除后胰岛对在高血糖条件下分泌的胰岛素量减少。这表明细胞外基质周转对于从基质中释放旁分泌因子很重要。
在T1D的治疗中,MSC展现出有效调节纤维化和组织再生的作用。在糖尿病动物模型中,间充质干细胞与胰岛联合移植比单独胰岛移植更有效。对糖尿病小鼠模型反复进行骨髓移植可恢复正常血糖,并使胰腺恢复正常形态。对糖尿病小鼠或大鼠全身性给予MSC可促进胰岛再生、增加内源性胰岛素生成、降低血糖水平、减少胰腺炎症过程并预防肾损伤。尽管一些研究表明间充质干细胞的旁分泌功能有助于间充质干细胞的有益作用,但间充质干细胞条件培养基的效率远低于间充质干细胞移植。当间充质干细胞与胰岛共移植到糖尿病动物体内时,可以明显观察到间充质干细胞对胰岛细胞的有益作用。
一些间充质干细胞产生的因子有助于维持胰岛β细胞功能和存活率,因此将胰岛细胞与间充质干细胞共同移植可以提高胰岛移植的效率。
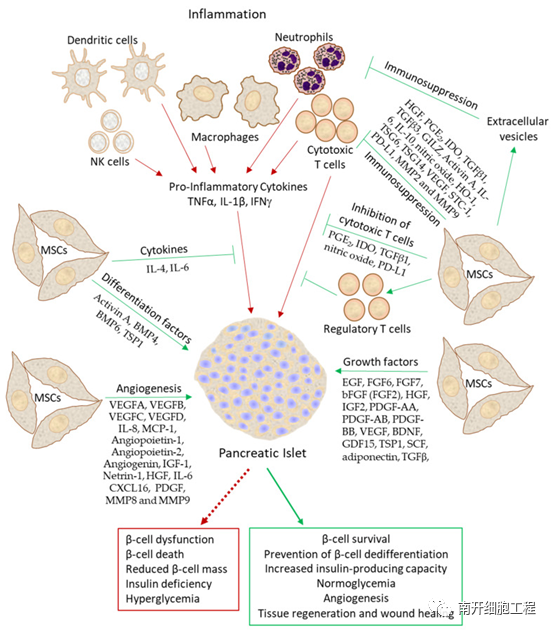
图2 间充质干细胞对胰岛β细胞有益作用的例证
(绿色箭头表示间充质干细胞对β细胞的有益作用,红色箭头表示炎症对β细胞的有害影响)
5 讨论与展望
在本文中,我们首先讨论了胰岛细胞移植作为Ⅰ型糖尿病的一种治疗方案,尽管具有广阔的应用前景,仍不可避免地存在慢性免疫抑制的问题。为了保持胰岛细胞离体后的形态与功能,以及应对慢性免疫抑制的问题,我们讨论了间充质干细胞对胰岛β细胞保护作用及其对自体免疫的抑制作用。迄今为止,体内研究的重点是探讨间充质干细胞的移植是否伴随免疫抑制治疗,这种疗法短期来看是有效的,在一些糖尿病患者体内也可以达到长期的治疗效果。考虑到从动物研究中获得的数据,将间充质干细胞与胰岛移植相结合是可取的。然而用于移植的胰岛细胞数量是有限的,因此体外保持胰岛β细胞的活性与功能仍然需要进一步的研究。可以通过对MSC分泌组进行深入探索,优化生长因子组成,以保持β细胞功能,并提高体外β细胞分化的效率,保持胰岛的离体功能。