
近年来,科学家们在干细胞研究领域取得了重大突破,尤其是在全能性干细胞的捕获和培养方面。全能性干细胞是一类具有最高发育潜能的细胞,能够形成一个完整的生物体,包括胚内外的所有组织。尽管科学家们已经在小鼠和人类扩展型多能干细胞(EPSC)的培养方面取得了一定进展,但如何在体外稳定捕获和维持真正的全能性干细胞一直是一个未解难题。
2024年6月5日,北京大学生命科学学院、北大-清华生命科学联合中心、北京大学核糖核酸研究中心的杜鹏教授课题组在《Cell》杂志上发表了一篇重要研究论文,题为《通过抑制剪接体捕获人类细胞中的全能性》。这项研究首次通过抑制剪接体重编程人多能性干细胞,成功捕获了两种新型的全能性状态细胞。研究团队发现,通过使用剪接体抑制剂Pladienolide B(PlaB)处理人始发态多能干细胞,可以将这些细胞重编程为一种独特的ZGA-like细胞(ZLCs)。这些细胞在分子特征上与人类早期8细胞胚胎高度相似,表现出ZGA(合子基因组激活)时期的基因表达特征。然而,这些ZLCs无法在体外稳定维持,只能存在于短暂的时间内。
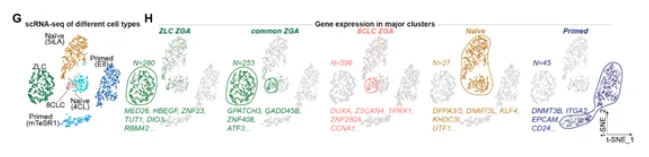
为了解决这一问题,研究团队开发了一种新的培养基MYCP,其中含有低浓度的PlaB。使用这种培养基,研究人员成功将ZLCs进一步重编程为具有pre-ZGA特征的全能性干细胞,即hTBLCs(human totipotent blastomere-like cells)。hTBLCs不仅能够在体外稳定培养,而且在转录组和表观组水平上与体内早期胚胎细胞具有高度相似的分子特征。通过一系列的实验,研究团队证明了hTBLCs的强大发育潜能。在体内和体外分化体系中,hTBLCs不仅能够产生胚内细胞谱系,还能分化出胚外细胞谱系。这些结果表明,hTBLCs是真正意义上的全能性干细胞,具有广泛的应用前景。
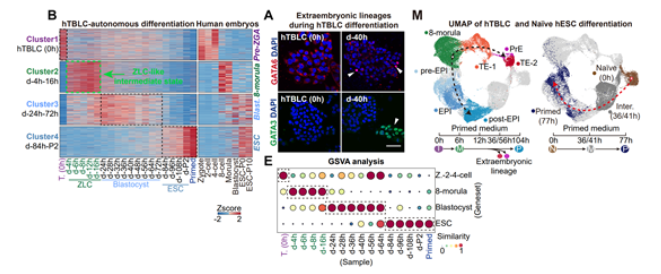
研究还显示,基于hTBLCs的自发分化体系可以模拟人类胚胎着床前的发育过程。这一发现为科学家们提供了一个用于研究人类早期胚胎发育的新工具。同时,hTBLCs在不添加任何化学小分子的条件下,能够在人胚胎培养基中形成类囊胚结构,这一成果进一步证明了其全能性特征。这项研究不仅首次捕获并稳定培养了具有pre-ZGA特征的人类全能性干细胞,还揭示了剪接体抑制作为一种通用策略,可以推动多种物种干细胞从多能性向全能性的转变。未来,hTBLCs有望在再生医学和类器官研究等领域发挥重要作用。
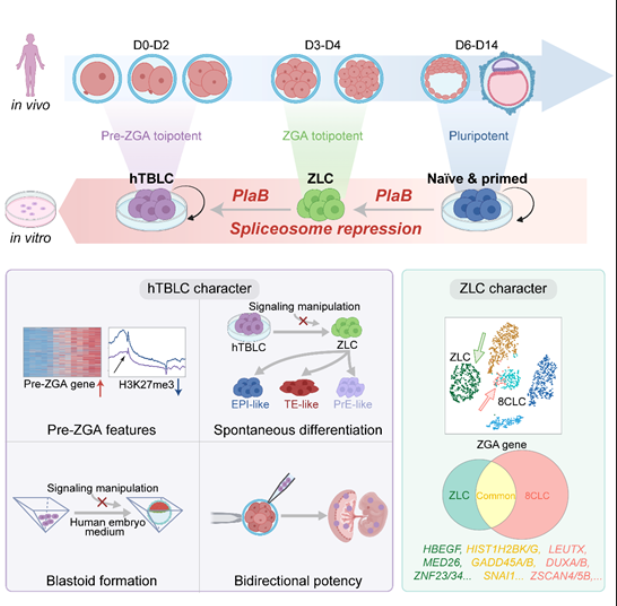
总之,杜鹏教授团队的这项研究为科学家们提供了一个新的研究方向和方法,未来有望推动再生医学的发展,造福更多的患者。研究成果不仅进一步深化了我们对全能性干细胞的理解,也为实现体外培养和应用全能性干细胞提供了坚实的科学基础。
信息来源:https://doi.org/10.1016/j.cell.2024.05.010