
Tau病变,其特征表现为Tau蛋白聚集,是一组异质性的神经退行性疾病。最常见的Tau病变性疾病包括阿尔茨海默病(AD),以及具有Tau病变的额颞叶退行性疾病亚型(frontotemporal lobar degenera tion with Tau pathology,简称FTLD-Tau),如皮克病(Pick’s disease,简称PiD)、皮质基底退化(corticobasal degeneration,简称CBD)、进行性核上性麻痹(progressive supranuclear palsy,简称PSP)等,目前发病机制尚不清楚。
Tau蛋白由单个MAPT基因编码,并由外显子10选择性剪接从而形成六种异构体,包括含有三个(3R)或四个(4R)微管结合重复序列的异构体。Tau蛋白病有三种亚型,即3R、4R以及3R/4R混合型,在冷冻电子显微下展现出不同的Tau蛋白纤维结构。所以,AD(3R/4R)、PiD(3R),以及CBD(4R)中的 Tau蛋白丝,在结构上也存在差异,其中造成家族性额颞叶变性病例则表现为4R特异性。缺乏良好的4R Tau研究模型是限制相关疾病发生发展研究以及疗法发现的重要原因。
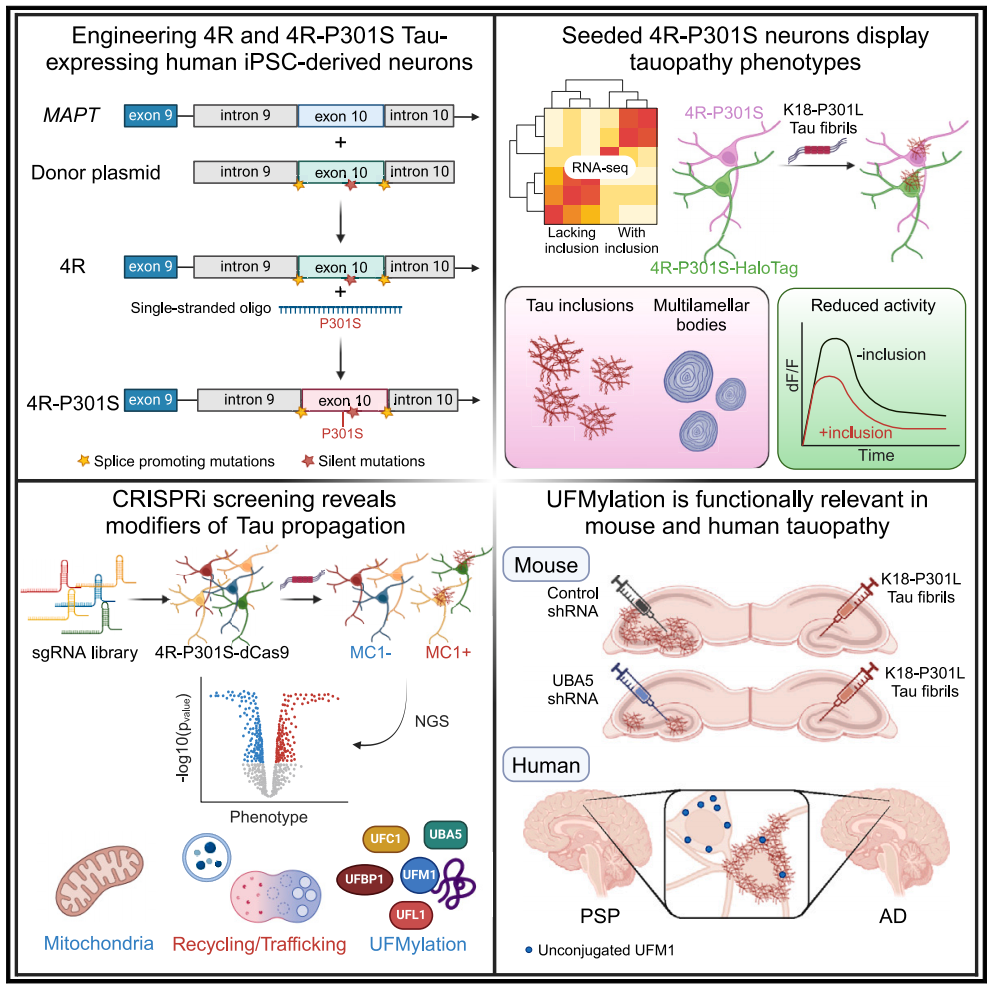
人诱导多能干细胞(Human induced pluripotent stem cell,简称hiPSC)来源的神经元在模拟神经系统疾病,包括但不限于Tau病变性疾病,价值并不明显。结合CRISPR-Cas9技术,iPSC来源的神经元平台通过等位基因改造,实现了精确的疾病模型化和功能基因组学分析,从而可以识别疾病相关调控因子。然而,即使在长时间培养后,iPSC来源的神经元表达的4R Tau水平也非常低,因此不适合模拟如PSP这样的4R Tau病变性疾病。包含外显子10的Tau水平低也限制了它们在模拟位于外显子10的显性家族性FTLD-Tau突变方面的相关疾病。此外,还难以在人类iPSC来源的神经元中复现稳定的Tau聚集。尽管在MAPT-P301L或MAPT-IVS10+16 iPSC神经元中未观察到不溶性Tau聚集,但在120天后,可以观察到数目稀少的Tau包含体。导致这一现象的一个重要因素可能是iPSC来源的神经元中缺乏4R Tau。
近日,来自美国纽约Weill Cornell Medicine的Shiaoching Gong和Li Gan研究组在Cell上发表题为"Human iPSC 4R tauopathy model uncovers modifiers of tau propagation"的文章,成功建立了一套稳健且具有扩展能力的人类iPSC 4R Tau病变性疾病模型。

研究团队构建了工程化的人类诱导多能干细胞系,这些神经元表达4R Tau及携带P301S MAPT突变的4R Tau。通过Tau原纤维种子(seeding)的诱导,在4R-P301S神经元中显示出进行性Tau包涵体的积累,并复制了Tau蛋白病的表型特征,包括转录组特征、自噬体积聚和减少的神经元活动。
通过对与Tau病理学相关的基因进行CRISPR干扰(CRISPRi)筛选,鉴定出超过500个诱导Tau传播的遗传修饰因子,包括retromer VPS29和UFMylation级联反应中的基因。在进行性核上性麻痹(PSP)和阿尔茨海默病(AD)病人大脑中,UFMylation级联反应在神经纤维缠结的神经元中发生改变。最后,在体外和体内抑制UFMylation级联反应阻断了Tau蛋白的传播。这个模型为寻找4R Tau蛋白病的新治疗策略提供了一个强大的平台。
人类iPSC 4R节段性病变模型发现tau传播的修饰物
综上,研究团队展示了一套稳健且可扩展的人类iPSC 4R Tau病变性疾病模型。通过工程化hiPSC细胞系,使其在分化成神经元时表达4R Tau和携带P301S MAPT突变的4R Tau(4R-P301S),并确定了4R-P301S神经元可以在一定程度上模拟Tau病变性疾病的病理特征。另外,研究团队还整合CRISPRi和功能基因组筛选,识别出参与Tau病变性疾病的新分子和通路,为发现潜在的治疗策略提供了新思路。
当然,这套模型的主要缺陷有两处,一是无法复刻人类大脑中衰老神经元的特征,而衰老是AD的发病诱因之一;二是并没有重现AD的Tau病变,因为AD病人所携带Tau是3R/4R复合型,而这套模型仅表达4R。这两点也是
升级该模型的重点方向。
原文链接:https://doi.org/10.1016/j.cell.2024.03.015