
多发性硬化症(MS)是一种慢性炎症性和神经退行性疾病,影响中枢神经系统(CNS),其发病机制复杂,涉及环境因素(如Epstein-Barr病毒感染)和遗传因素的相互作用。在疾病早期,MS通常表现为局部神经症状,这些症状由急性脱髓鞘病变引起,并有一定程度的内源性修复(复发缓解型MS [RRMS])。较少的患者(<15%)从疾病开始就经历持续进展的病程(原发性进行性MS [PPMS]),这与较差的预后相关。随着时间的推移,大多数RRMS患者会发展为继发性进行性MS(SPMS),其特点是神经功能障碍的稳步累积,与修复机制失败和神经退行性变有关。
在RRMS中,外周免疫细胞浸润和炎症非常明显,针对B细胞或T细胞的治疗显著减少了新的病变和复发。不幸的是,这些治疗在预防推动疾病进展的神经退行性变方面效果有限,这表明存在独立于外周免疫的疾病机制。慢性MS进展背后的机制只有部分被理解,这突显了一个迫切未满足的需求。
单细胞测序网讯:2024年8月26日,来自纽约干细胞基金会(NYSCF)研究所的高级研究调查员Valentina Fossati 博士团队和凯斯西储大学(Case Western Reserve University)医学院神经胶质科学研究所所长 Paul J. Tesar博士团队在Cell Stem Cell上以“Patient iPSC models reveal glia-intrinsic phenotypes in multiple sclerosis”为题在线发表了一篇论文,创建了迄今规模最大的多发性硬化症(MS)患者干细胞模型集合,并利用单细胞基因组学等先进技术,首次发现了多发性硬化症患者的神经胶质细胞具有疾病的内在特征,不受免疫系统的影响。凯斯西储医学院的助理教授本杰明-克莱顿(Benjamin Clayton)博士和圣路易斯华盛顿大学博士生莉莉安-巴巴(Lilianne Barbar)为这项研究共同第一作者。

研究小组利用NYSCF自动化平台的强大功能,从多发性硬化症患者的皮肤活组织切片中制造出诱导多能干细胞(iPSC),形成了迄今为止规模最大的多发性硬化症患者干细胞系,涵盖不同的临床亚型。然后,他们将iPSC转化为胶质细胞(包括少突胶质细胞和星形胶质细胞),以研究它们在疾病中的作用。
“体内环境会不断被免疫细胞和炎症信号改变,通过从干细胞中生成富含胶质细胞的培养物,我们能够独立于体内复杂环境来研究它们在MS中的作用。”Fossati博士说。
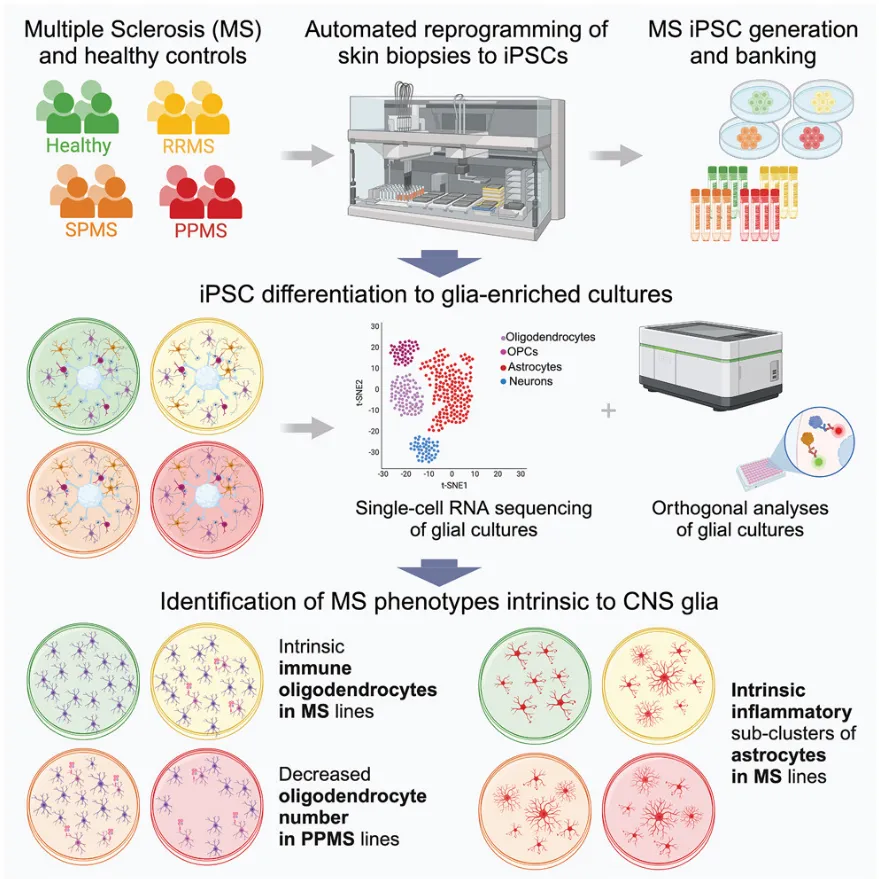
通过单细胞基因表达谱分析,科学家们发现,来自原发性进行性多发性硬化症(一种特别严重的疾病)患者的干细胞衍生胶质细胞培养物中含有较少的少突胶质细胞。少突胶质细胞负责产生髓鞘,髓鞘是神经纤维周围的保护性鞘膜,在多发性硬化症中丧失。
Paul Tesar博士指出:“这一观察结果挑战了人们对多发性硬化症纯粹由免疫系统功能障碍驱动的传统认识,表明这种疾病也可能是由大脑本身的生物过程引发的。”
研究小组还观察到,一组与免疫和炎症功能相关的基因在多发性硬化症患者干细胞衍生的胶质细胞培养物中特别活跃,这与他们在多发性硬化症患者的大脑样本中看到的情况相吻合。此外,NYSCF的科学家们利用人工智能的最新技术,检测出了人眼不易察觉的星形胶质细胞的差异。
由于多发性硬化症的自身免疫活动,目前许多疗法都以免疫系统为靶点。这些药物有助于降低免疫攻击的频率,但不幸的是,它们无法阻止导致疾病进展的神经退行性变。
这项研究的发现为治疗多发性硬化症提供了新的可能性。通过确定导致疾病的特定神经胶质细胞行为,研究人员现在可以探索直接针对这些细胞的潜在疗法,这可能会是更有效的治疗方法,而不仅仅是抑制免疫系统。
这项研究的发现代表了人们对多发性硬化症认识的重大飞跃,强调了神经胶质作为治疗干预靶点的巨大潜力,这可能会改变许多患者的治疗前景。
原文献:https://doi.org/10.1016/j.stem.2024.08.002