
2024年10月22日,韩国首尔国立大学医学院生物医学科学系的研究人员在Nature methods杂志在线发表题为"Differentiating visceral sensory ganglion organoids from induced pluripotent stem cells"的研究论文。
这项研究成功建立了一种从人类诱导多能干细胞(iPSCs)分化出内脏感觉神经节类器官(VSGOs)的新方案。这些VSGOs不仅表现出典型的内脏感觉神经系统(VSNs)标志物,而且通过单细胞RNA测序(scRNA-seq)技术,揭示了它们与天然VSNs在异质性分子特征和发育轨迹上的一致性。研究团队进一步将VSGOs与人类结肠类器官(HCOs)集成在一个微流控芯片上,构建了一个模拟肠道-神经-大脑轴的体外模型,特别应用于阿尔茨海默病(AD)的研究。
研究发现,VSNs可能通过APOE4和LRP1依赖的方式,促进肠道源性的淀粉样蛋白(Aβ)和tau蛋白传播至大脑,为理解AD等疾病的发病机制提供了新的视角。此外,这项研究还扩展到了使用来自AD患者的iPSCs,实验结果与临床数据展现出了强烈的相关性,进一步证实了该研究在转化医学和疾病模型研究中的重要价值。
01 背景

在研究神经系统疾病时,我们发现内脏感觉神经系统(VSNs)起着关键作用。这些神经源自胚胎期的上鳃板(EpP),能够感知肠道信号,并通过迷走神经传递给大脑,对肠道-神经-大脑轴的功能至关重要。
近年来,随着对肠道微生物组与神经系统疾病关系认识的深入,人们越来越关注这一轴在诸如阿尔茨海默病(AD)等神经退行性疾病中的作用。尽管已有研究通过操纵肠道微生物组来减轻神经疾病小鼠模型的病理变化,但这些研究大多依赖于体内模型,限制了对肠道-迷走神经-大脑轴的深入研究。
为了在体外模拟这一轴并研究其在神经退行性疾病中的作用,研究者们尝试利用诱导多能干细胞(iPSCs)分化为内脏感觉神经节类器官(VSGOs)。VSGOs能够表达多种与VSNs相同的分子标记,并且通过单细胞RNA测序(scRNA-seq)揭示了VSGOs与原生VSNs相似的异质性分子特征和发育轨迹。
然而,尽管在VSGOs的诱导分化方面取得了一定的进展,但目前的研究仍存在一些空白和挑战。例如,如何更精确地模拟体内环境以促进VSGOs的成熟和功能,以及如何将这些类器官与肠道类器官(HCOs)有效整合,构建一个能够模拟肠道-神经-大脑轴的体外模型,即所谓的“器官芯片”(Organs-on-a-Chip)模型,是当前研究的热点和难点。
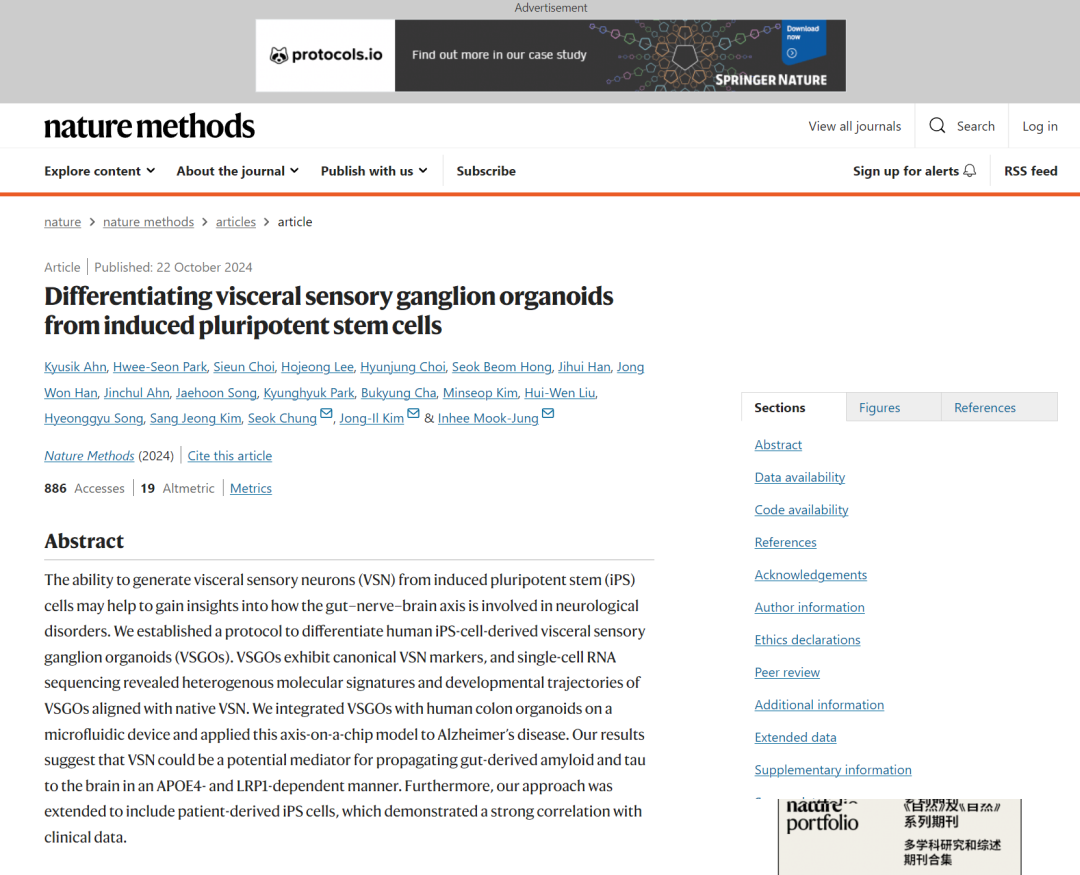
从iPS细胞中分化出OEPD和EpP
02 研究步骤

在这样的背景下,研究者们开始了研究。
在探索内脏感觉神经系统(VSNs)在神经退行性疾病中的作用时,一个核心的科学问题浮现出来:“VSNs是否能够作为肠道源性病理蛋白传播到大脑的媒介?”
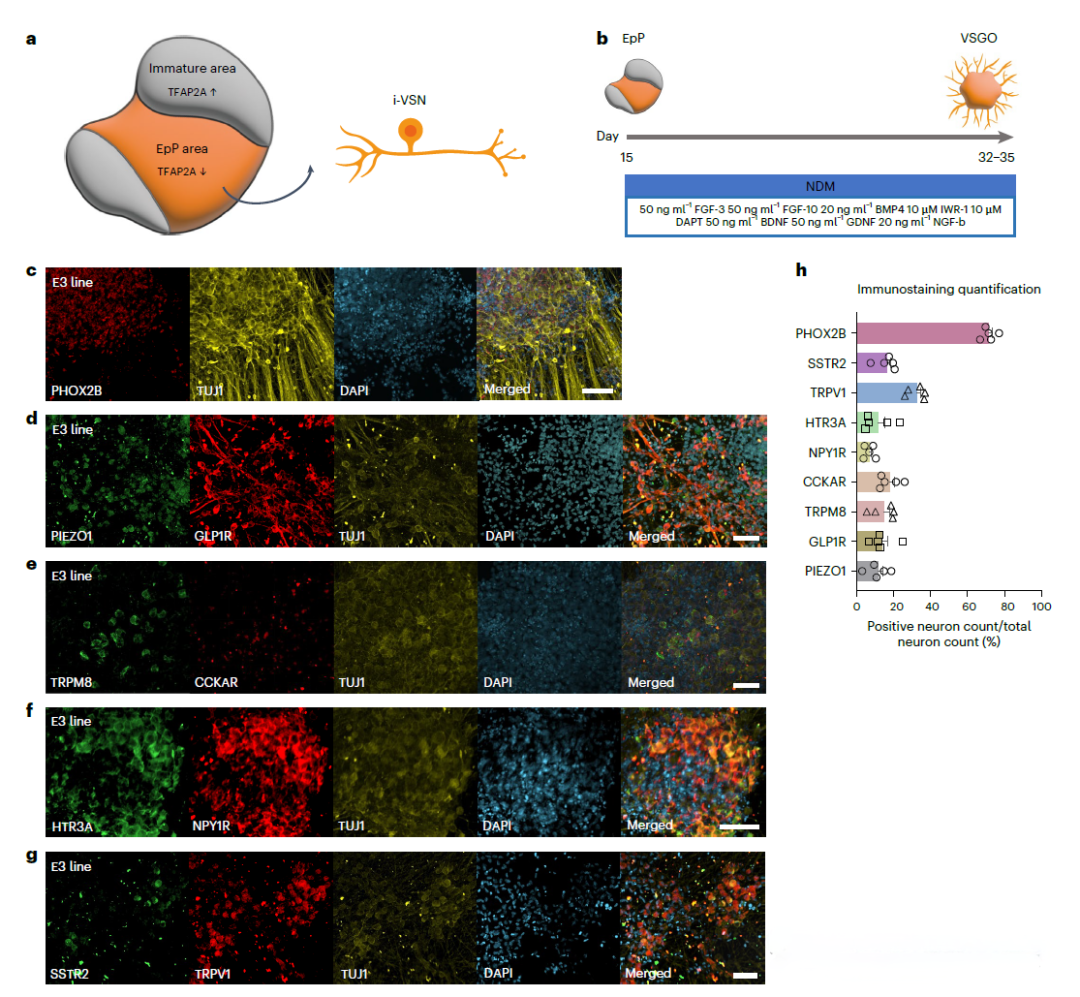
基于当前对肠道-神经-大脑轴的认识,研究者们提出了一个假说:VSNs可能在传播肠道源性的淀粉样蛋白Aβ和tau蛋白至大脑的过程中起到关键作用。为了验证这一假说,研究者们采取了一种创新的研究思路,即通过诱导多能干细胞(iPSCs)分化生成VSGOs,并将其与结肠类器官(HCOs)整合在一个微流控芯片上,构建了一个体外模型来模拟肠道-神经轴。
利用这一模型,研究者们观察到VSGOs能够表达多种VSNs特异性分子标记,并通过单细胞RNA测序分析揭示了与原生VSNs相似的异质性分子特征和发育轨迹。进一步的实验中,通过在HCOs中加入荧光标记的Aβ和tau蛋白,并观察这些蛋白在VSGOs中的传播情况,结果发现这些病理蛋白能够通过VSNs传播,且这一过程受到APOE基因型的影响。特别是,APOE4等位基因的存在显著增强了VSNs对Aβ和tau蛋白的摄取能力。此外,通过使用来自阿尔茨海默病患者的iPSCs进行实验,研究者们发现这些VSGOs中Aβ和tau的传播与患者的临床数据存在显著相关性,这进一步证实了VSGOs在模拟疾病病理过程中的可靠性。
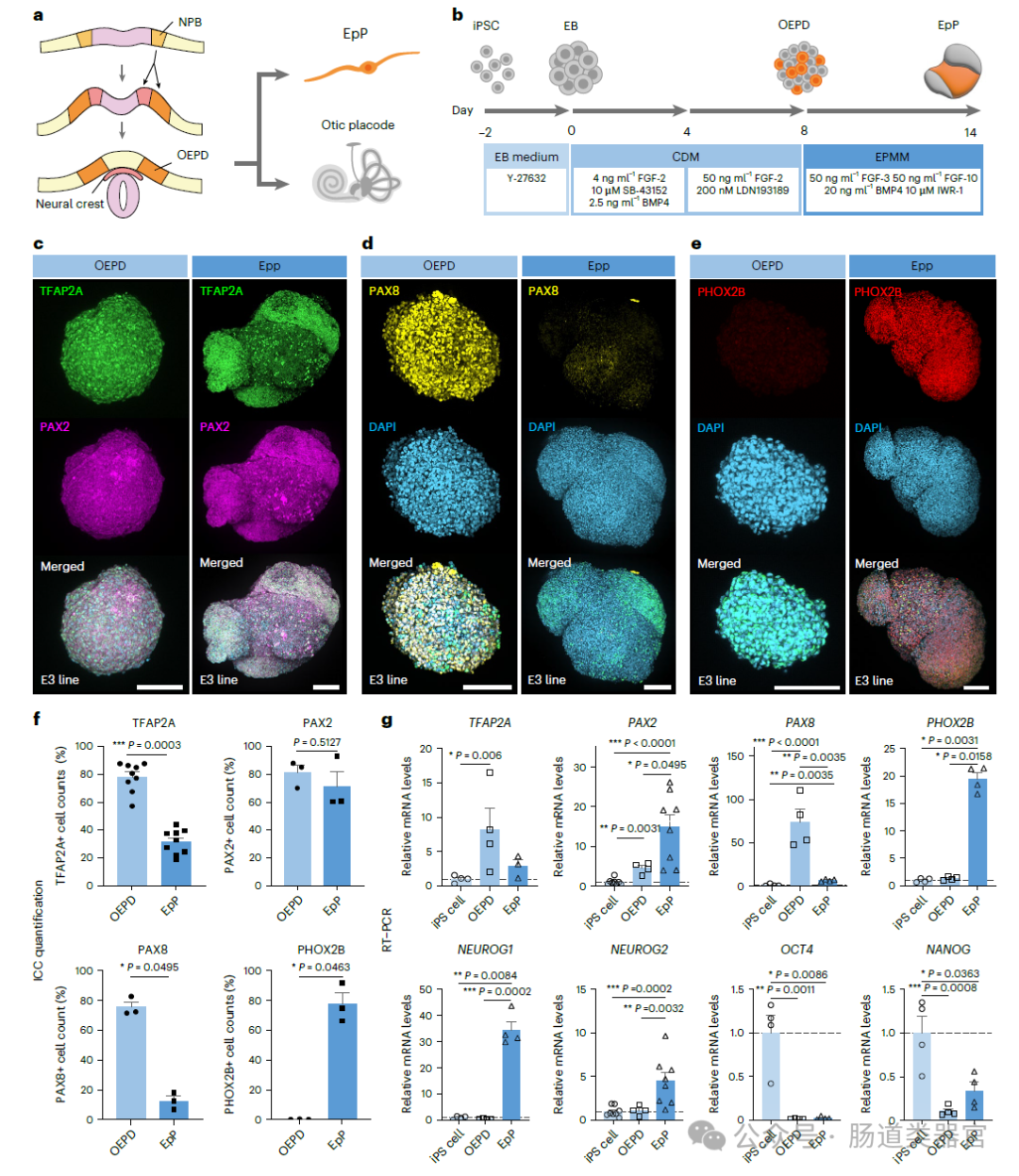
与EpP区分的VSSYS中典型VSN标记物表达
在这项研究中,类器官的培养步骤被精心设计,以确保从诱导多能干细胞(iPSCs)能够有效地分化为内脏感觉神经节类器官(VSGOs)以及结肠类器官(HCOs)。
培养VSGOs的步骤如下:
· 诱导上鳃板(EpP)形成:首先,通过特定培养基诱导iPSCs形成耳-上鳃板前体域(OEPD)。这一步骤涉及到使用特定的生长因子和抑制剂,如FGF和BMP,以促进OEPD的形成。
· 分化为VSGOs:随后,OEPD被进一步诱导分化为EpP,进而分化为VSGOs。在此过程中,通过调整FGF、Wnt和BMP信号通路,以及添加β-NGF、BDNF和GDNF等神经营养因子,促进VSN的生成。
· VSGOs的成熟:VSGOs在特制的培养基中成熟,该培养基支持神经元的存活和功能表达,直至达到实验所需的成熟度。
培养HCOs的步骤如下:
· iPSCs的分化:iPSCs被分化为肠道上皮细胞,通过一系列生长因子和信号通路的调控,模拟肠道发育过程。
· HCOs的形成:分化后的肠道上皮细胞通过自组织形成HCOs,这些类器官能够在体外模拟肠道的功能和结构。
培养这些类器官的应用目的是为了建立一个体外模型,用以研究肠道-神经-大脑轴在神经退行性疾病中的角色。
通过将VSGOs和HCOs整合在微流控芯片上,研究者们构建了一个三维的“轴-芯片”系统,以模拟肠道到大脑的信号传递。这一系统不仅能够模拟VSNs与肠道的相互作用,还能研究这些相互作用如何影响大脑,特别是在疾病状态下。例如,通过在HCOs中加入标记的Aβ和tau蛋白,研究者们能够观察这些病理蛋白是如何通过VSNs传播至大脑的,进而探索它们在阿尔茨海默病(AD)等疾病中的作用。此外,该模型还允许研究者评估不同遗传背景(如APOE基因型)对病理传播的影响,以及探索潜在的治疗策略。通过这种方式,研究提供了一个强大的平台,以深入理解并模拟复杂的生物学过程,并为未来的药物开发和疾病研究开辟新的道路。
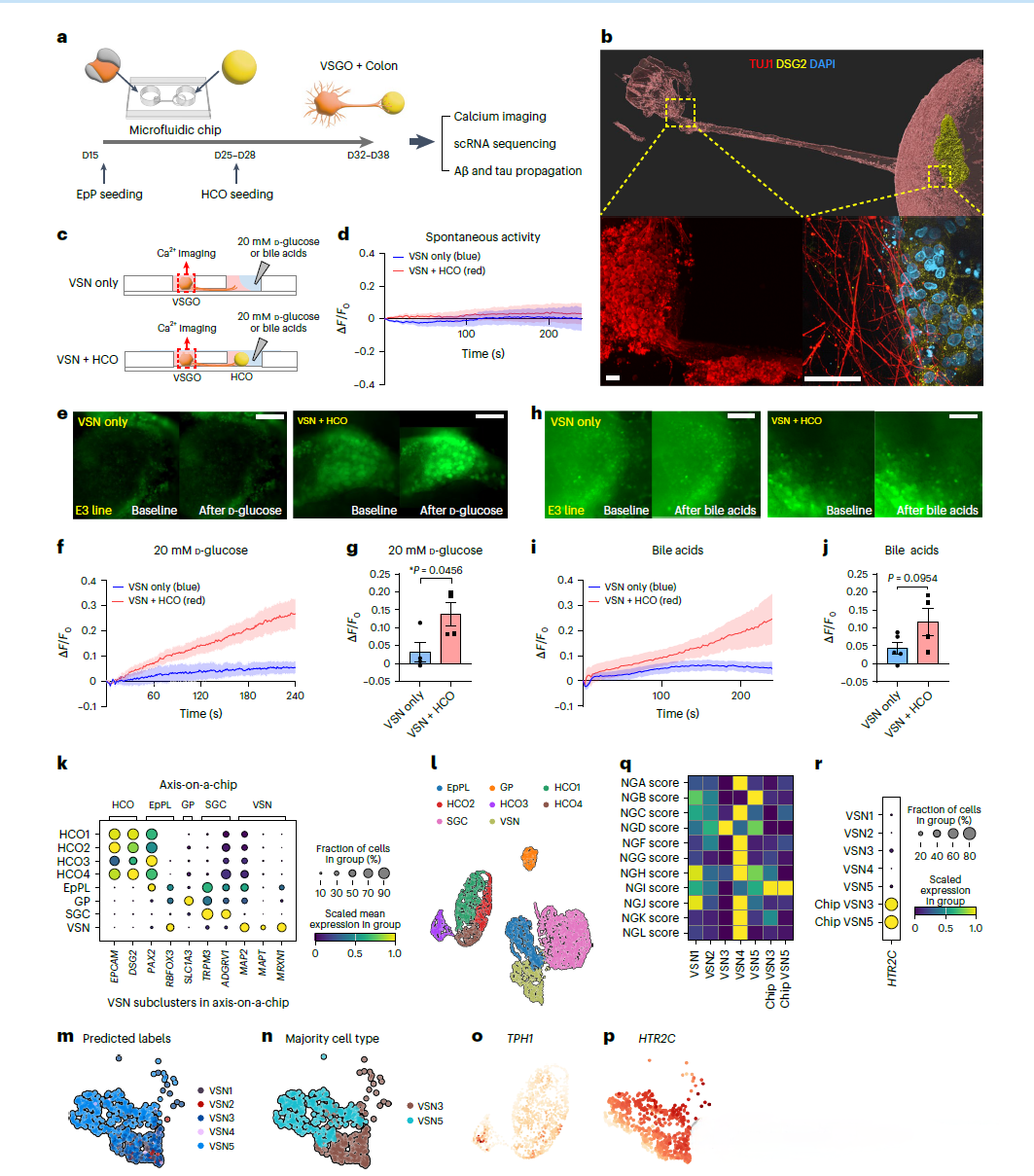
使用微流控芯片建立连接VSGO和HCO的3D片上轴
这项研究通过创造性地应用诱导多能干细胞(iPSCs)分化技术,构建了内脏感觉神经节类器官(VSGOs),并将这些类器官与结肠类器官(HCOs)结合在微流控芯片上,成功模拟了肠道-神经-大脑轴的关键环节。这一体外模型为探索肠道与大脑间的互动及其在神经退行性疾病中的影响提供了强有力的工具。
该研究不仅展现了VSGOs在将肠道源性的病理蛋白传递到大脑中的潜在功能,还强调了APOE基因型在病理传播过程中的作用,为揭示阿尔茨海默病(AD)等疾病的发病机制提供了新的视角。此外,该研究为未来药物的开发和治疗策略的探索提供了重要的实验平台。尽管研究存在局限,但其成果无疑加深了我们对复杂生物学过程的认识,并为相关疾病的研究开辟了新途径。