
类风湿性关节炎(RA)是一种以关节慢性炎症和进行性骨破坏为特征的自身免疫性疾病。
尽管现有药物(如甲氨蝶呤、生物制剂)可缓解症状,但部分患者仍面临疗效不足或副作用问题。
近年来,间充质基质细胞(MSCs)因其独特的免疫调节和组织修复能力,成为RA治疗研究的热点。本文将重点解析MSCs的临床作用机制及研究进展。
MSCs通过直接接触或分泌外泌体、细胞因子等活性物质,调控RA病理中的关键细胞:
1. 抑制成纤维样滑膜细胞(RA-FLS)侵袭性
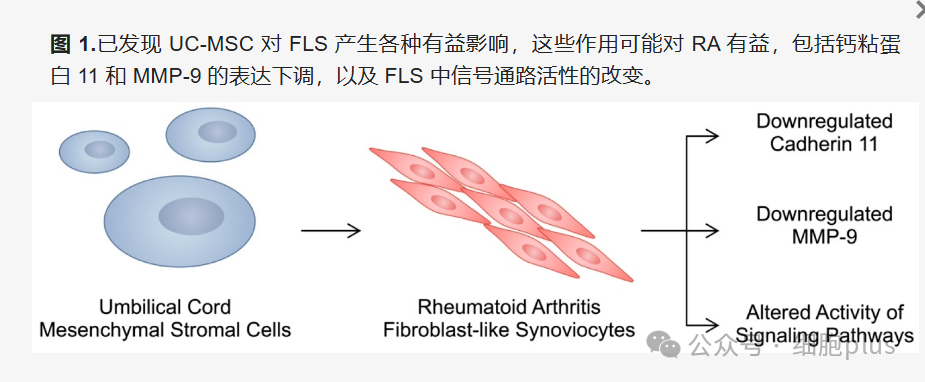
RA-FLS是导致关节破坏的“元凶”之一,其异常增殖和迁移会加剧血管翳形成及软骨降解。研究发现,脐带来源MSCs(UC-MSCs)可通过外泌体传递miRNA(如miR-140-3p、miR-451a),抑制RA-FLS中促炎因子(IL-1β、TNF-α)和基质金属蛋白酶(MMP)的表达,从而减少组织破坏。此外,MSCs还能下调钙粘蛋白11(CDH11)水平,阻断RA-FLS与免疫细胞的促炎信号传递。
2. 调控巨噬细胞极化
滑膜中的M1型巨噬细胞分泌大量TNF-α、IL-6等促炎因子,加速炎症级联反应。MSCs通过释放IL-6和TGF-β1,促使M1型巨噬细胞向抗炎M2型转化,减少破骨细胞生成,延缓骨侵蚀。动物实验显示,MSC治疗可显著降低关节局部TNF-α水平,改善病理评分。
3. 平衡T细胞亚群
Th17/Treg细胞失衡是RA的核心病理机制。临床前研究表明,MSCs通过分泌前列腺素E2(PGE2)和吲哚胺2,3-双加氧酶(IDO),抑制Th17分化并促进Treg增殖,从而降低IL-17、IFN-γ等促炎因子,同时升高IL-10、TGF-β等抗炎介质。例如,UC-MSCs在临床试验中可使患者外周血Treg比例提高,Th17相关指标显著下降。
多项动物和人体试验验证了MSCs的安全性和潜在疗效:
· 动物模型效果明确
在胶原诱导关节炎(CIA)小鼠中,UC-MSCs静脉注射可显著减轻关节肿胀,降低IL-6、TNF-α水平,且疗效与甲氨蝶呤相当。组织学分析显示,治疗组关节破坏程度接近健康对照组。

· 临床试验初显潜力
一项针对RA患者的临床研究显示,联合UC-MSCs与常规抗风湿药(DMARDs)治疗3个月后,患者DAS28评分、C反应蛋白(CRP)和类风湿因子(RF)水平显著降低,且无严重不良反应。长期随访(3年)数据表明,关节功能和生活质量持续改善。


· 新型给药策略探索
研究尝试将姜黄素等抗炎成分装载至MSC外泌体中,发现其抑制滑膜细胞活性的效果优于单一药物,为靶向治疗提供了新思路。