
再生医学浪潮翻涌,多能干细胞疗法凭借其巨大的应用潜力与不断涌现的突破性成果,正跃升为全球医疗领域最炙手可热的赛道。
近来,这一前沿领域传来振奋人心的进展 —— 不仅为难治性疾病的治疗开辟了全新路径,更给整个再生医学的发展注入了强劲动能,让攻克疑难病症的希望愈发清晰。
人多能干细胞来源周细胞移植可有效延缓APOE4/4小鼠的痴呆发生
近日,中山大学中山医学院李伟强、项鹏教授团队联合中山大学附属八院陈燕铭教授团队Translational Neurodegeneration杂志上发表题为Transplantation of hiPSC-derived pericytes rescues Alzheimer’s disease phenotypes in APOE4/4 mice through IGF2-rich apoptotic vesicles的文章。
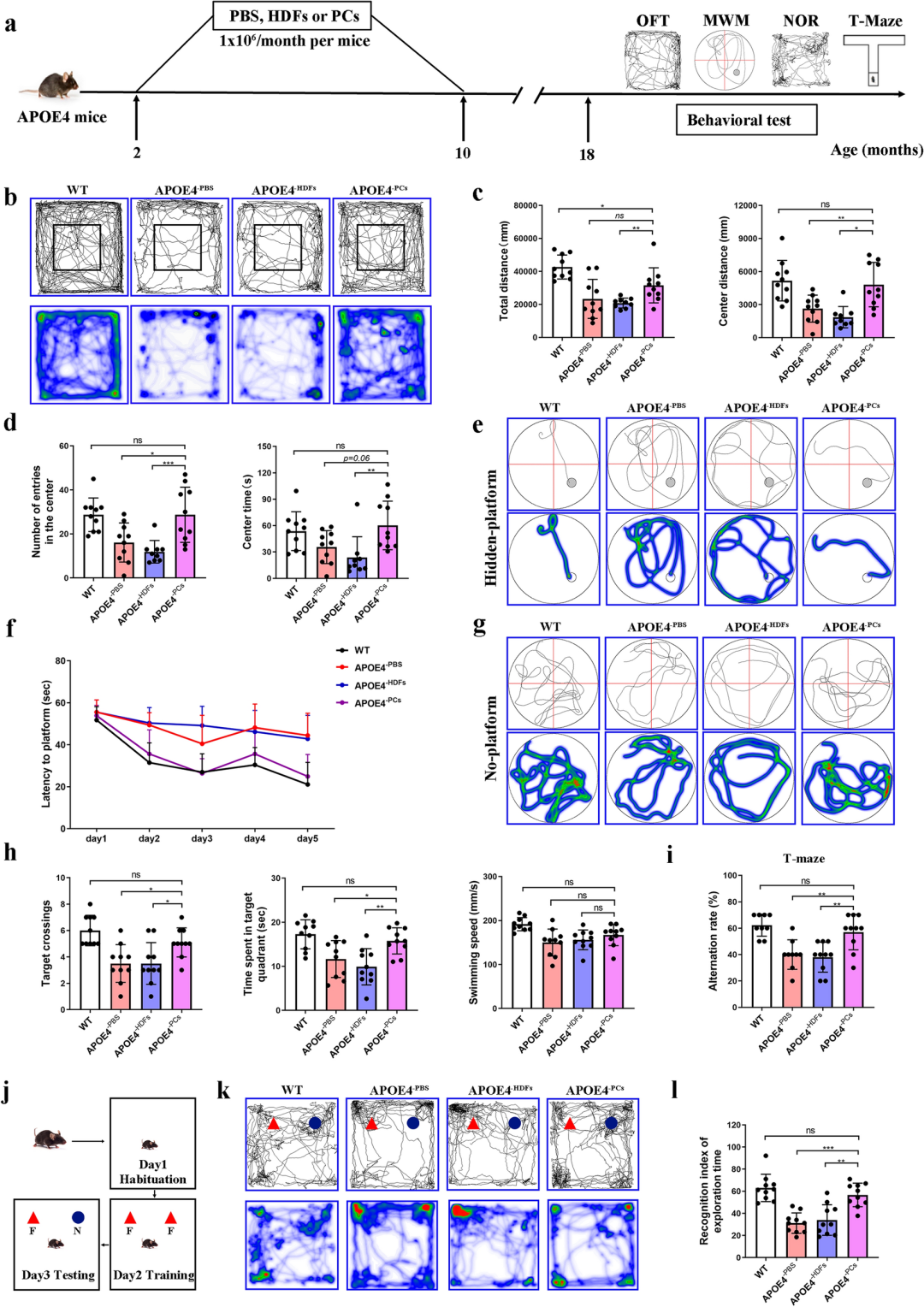
该研究发现单次周细胞移植并不能改善老年APOE4/4人源化小鼠的认知行为学,而在早期、多次细胞移植可显著逆转APOE4/4人源化小鼠的认知能力下降,明显减轻Aβ沉积/p-Tau形成/神经元死亡等AD典型病理特征、内源性周细胞丢失及BBB的破坏。证实周细胞移植可显著延缓APOE4/4相关AD表型的进展,提示了针对AD患者开展基于病理表型早期干预的必要性。
阿尔茨海默症(AD)被誉为 “药物研发的黑洞”,目前尚无有效药物能显著逆转或阻止其病情进展,亟待深入探究发病机制、挖掘新型治疗靶点。
研究显示,APOE4是AD的最强遗传风险因素:携带1个拷贝的人群(占比10-15%)患病风险升高3-5倍,携带2个拷贝的人群(占比2-3%)风险提升8-12倍。
值得关注的是,APOE4携带者在认知能力下降、淀粉样蛋白(Aβ)沉积出现前,就已存在显著的脑微血管周细胞损伤及血脑屏障(BBB)破坏,且这一病变与认知衰退密切相关,提示其可能是APOE4相关AD的关键始动因素。
研究团队此前已证实,移植人诱导多能干细胞(hiPSCs)来源周细胞,可显著减轻缺血性脑卒中小鼠的血脑屏障损伤、恢复其神经功能,这也意味着周细胞移植有望成为APOE4相关AD的潜在治疗方案。
技术路线
研究团队证实单次周细胞移植治疗并不能有效改善老年APOE4/4人源化小鼠的认知能力,而早期、多次细胞移植治疗可显著逆转APOE4/4人源化小鼠的认知能力下降,显著减轻AD典型病理特征、内源性周细胞丢失及BBB的破坏。
随后利用tdTomato荧光标记后的周细胞在小鼠体内进行示踪,发现移植后在小鼠脑部主要存在直径为0.5-5μm、表达CD9、CD63、CD81(囊泡标志物)和cleaved-caspase3(细胞凋亡标志物)的凋亡囊泡(apoptotic vesicles,ApoVs),且内源性APOE4/4周细胞可大量吞噬该ApoVs,提示ApoVs是移植后周细胞发挥作用的关键。
研究团队进一步对周细胞来源ApoVs(ApoVs-PCs)进行转录组测序及蛋白质谱分析,发现胰岛素样生长因子2(IGF2)mRNA和蛋白水平在ApoVs-PCs中显著富集。随后,将体外获得的ApoVs-PCs进行体内移植实验。
发现经尾静脉移植后的ApoVs-PCs仍可通过血液循环到达APOE4/4小鼠脑部,早期、多次的ApoVs-PCs移植也可以显著逆转老年APOE4/4人源化小鼠的认知能力下降,显著减轻AD典型病理特征及BBB的破坏。而敲除IGF2后的ApoVs-PCs体外治疗作用显著减弱,进一步提示IGF2在该治疗过程中发挥关键作用。
hipsc来源的周细胞移植通过富含igf2的凋亡囊泡拯救APOE4/4小鼠的阿尔茨海默病表型
结论
该研究首次证实早期、多次移植人诱导多能干细胞(hiPSCs)来源PCs或富含IGF2的ApoVs-PCs可显著逆转老年APOE4/4人源化小鼠的认知能力下降,不仅为APOE4相关AD提供可行性治疗方案,也为其他周细胞损伤或BBB损伤相关疾病提供了可行性方案。
构建早衰症血管类器官,发现SRF是防治血管衰老的潜在靶点
近期,中国科学院动物研究所刘光慧研究员、中国科学院北京基因组研究所(国家生物信息中心)张维绮研究员与中国科学院动物研究所曲静研究员合作,在Developmental Cell在线发表了题为“Vascular organoid model of Hutchinson-Gilford progeria syndrome uncovers repression of the SRF pathway in premature aging”的研究论文。
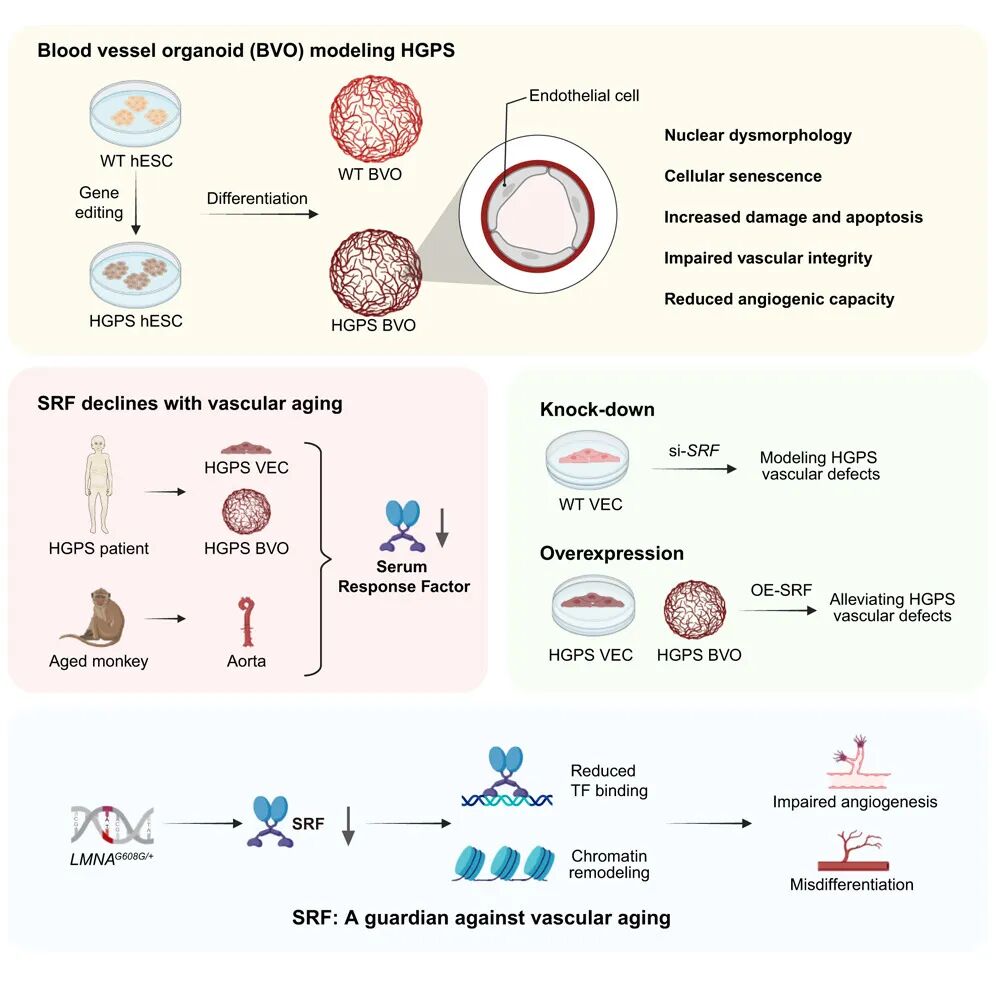
该研究利用基因编辑和人多能干细胞定向分化技术,首次成功构建了模拟HGPS的人类血管类器官(BVO)模型。该模型在三维尺度上高度重现了HGPS患者血管系统的多种病理特征。通过多组学整合分析,研究揭示了转录因子SRF(Serum Response Factor)的表达下调是驱动血管早衰的一个核心事件,为干预衰老相关心血管疾病提供了新的潜在靶点。
传统的二维(2D)细胞培养模型难以模拟血管的立体结构与体内微环境,无法真实反映血管发育和疾病过程中的复杂细胞间相互作用。
技术路线
该研究利用基因编辑和人多能干细胞定向分化技术,首次成功构建了模拟HGPS的人类血管类器官模型。该模型在三维尺度(3D)上高度重现了HGPS患者血管系统的多种病理特征,包括早衰蛋白积累、核膜内陷、基底膜结构不连续以及血管屏障功能受损。此外,模型还表现出血管新生能力衰退、DNA损伤增加、细胞凋亡增多及线粒体功能异常。
通过多维组学整合分析,研究人员发现,HGPS血管类器官中下调的基因富集于血管发育和生成通路,并锁定转录因子SRF为核心调控因子。
在HGPS模型及自然衰老的非人灵长类组织中,SRF表达均显著下调,表明其下降是跨物种保守的血管衰老标志。
功能实验证实,敲低SRF可重现血管衰老表型,而过表达SRF则能改善细胞核形态、减少DNA损伤并恢复血管生成能力。机制上,SRF通过直接结合并维持下游促血管生成基因(如VEGFA-VEGFR2通路组分)的染色质开放性,驱动血管稳态维持。该研究确立了SRF在血管衰老中的关键作用,为防治心血管疾病提供了潜在靶点。
图形摘要
结论
该研究首创性地利用人源血管类器官模型系统揭示了早衰性血管病变的分子机制,确立了SRF在维持血管稳态和延缓血管衰老中的关键作用。该成果不仅为理解人类血管衰老提供了强大的三维研究平台,也为开发针对早衰症及增龄性心血管疾病的防治策略提供了重要的理论依据和潜在的干预靶点。
总结
综上,两项研究从神经退行性疾病与血管衰老两大维度,展现了多能干细胞技术在疾病机制解析与治疗方案开发中的核心价值,更为阿尔茨海默症、早衰症等难治性疾病的干预提供了全新思路与潜在靶点,为全球再生医学领域的创新发展注入了强劲的中国力量。