
再生医学浪潮翻涌,多能干细胞疗法凭借其巨大的应用潜力与不断涌现的突破性成果,正跃升为全球医疗领域最炙手可热的赛道。
近来,这一前沿领域传来振奋人心的进展 —— 不仅为难治性疾病的治疗开辟了全新路径,更给整个再生医学的发展注入了强劲动能,让攻克疑难病症的希望愈发清晰。
iPSC来源EVs显著逆转NK细胞衰老,增强机体免疫功能
近期,上海交通大学附属第六人民医院的研究团队在国际权威期刊Stem Cell Research & Therapy上发表了一项重要研究成果。该研究首次揭示:诱导多能干细胞(iPSC)来源的小细胞外囊泡(iPSC-sEVs)可通过靶向调控CISH-STAT3信号通路,有效逆转自然衰老过程中自然杀伤细胞(NK细胞)的功能衰退,从而增强老年个体的抗肿瘤免疫能力。

人口老龄化背景下,免疫衰老已成为影响老年人健康的关键因素。NK细胞作为先天免疫系统核心效应细胞,在抗病毒、抗肿瘤免疫监视中作用关键。但随年龄增长,NK细胞不仅数量占比失衡,其细胞毒性、细胞因子分泌及免疫招募能力均显著衰退,导致老年人感染与癌症易感性上升。因此,逆转NK细胞衰老、恢复其免疫功能,已成为老年医学与肿瘤免疫治疗领域的研究重点。
技术路线
研究团队首先在自然衰老的小鼠模型中验证了iPSC-sEVs的干预效果。他们对12月龄的老年C57小鼠每周经尾静脉注射iPSC-sEVs,持续6个月。结果显示,接受iPSC-sEVs治疗的小鼠脾脏NK细胞中衰老标志物(如p21、γH2AX)表达显著降低,SA-β-gal活性减弱,同时抑制性受体KLRG1和NKG2C的表达下调,表明NK细胞的衰老表型得到部分逆转。
更关键的是,体外细胞毒性实验显示,经iPSC-sEVs处理的小鼠NK细胞,对 YAC-1淋巴瘤细胞的杀伤能力显著优于对照组。为验证体内抗肿瘤效果,研究人员将不同来源的NK细胞与B16黑色素瘤细胞共接种至同源小鼠皮下,结果表明,输注经iPSC-sEVs处理的老年NK细胞的小鼠,肿瘤体积与重量均明显低于对照组;免疫组化分析发现,其肿瘤组织内残留 NK 细胞(NCR1+)更多,肿瘤细胞增殖(Ki67+)受抑且凋亡(cleaved caspase-3+)增加。此外,该组肿瘤微环境中CD4+和CD8+T细胞浸润量显著提升,提示iPSC-sEVs不仅能直接增强NK细胞杀伤活性,还可提高其招募适应性免疫细胞的能力,进而形成高效抗肿瘤免疫微环境。
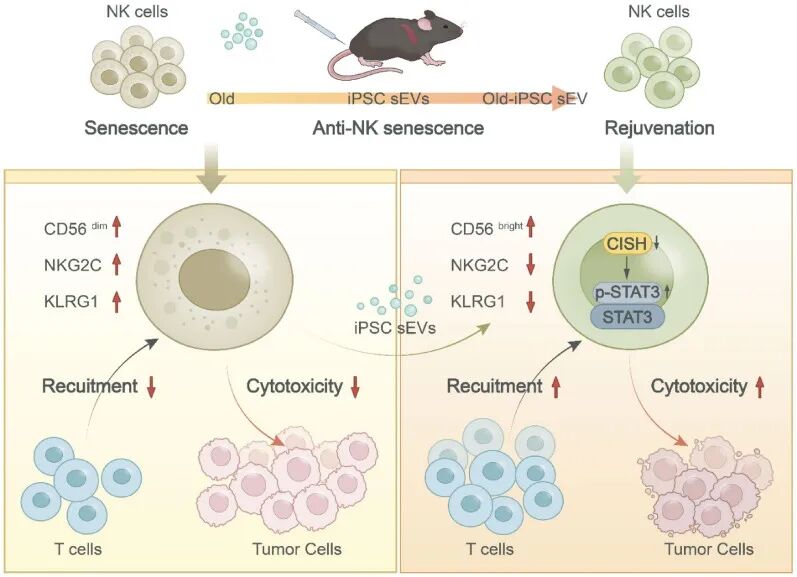
图形摘要
为探究作用机制,研究团队采用D-半乳糖构建人源NK细胞系NK92的衰老模型。经转录组测序与生物信息学分析,iPSC-sEVs处理可显著富集JAK-STAT、TNF等信号通路;其中衰老NK细胞高表达的CISH基因,在iPSC-sEVs干预后表达下调。后续实验证实,过表达CISH会促进NK92细胞衰老并抑制STAT3磷酸化,而STAT3激动剂可缓解D-半乳糖诱导的细胞衰老;若同时使用iPSC-sEVs与STAT3抑制剂,前者的抗衰老作用会被完全抵消。这表明iPSC-sEVs 通过抑制CISH表达,解除其对STAT3磷酸化的抑制,激活下游信号通路,最终恢复 NK 细胞功能。
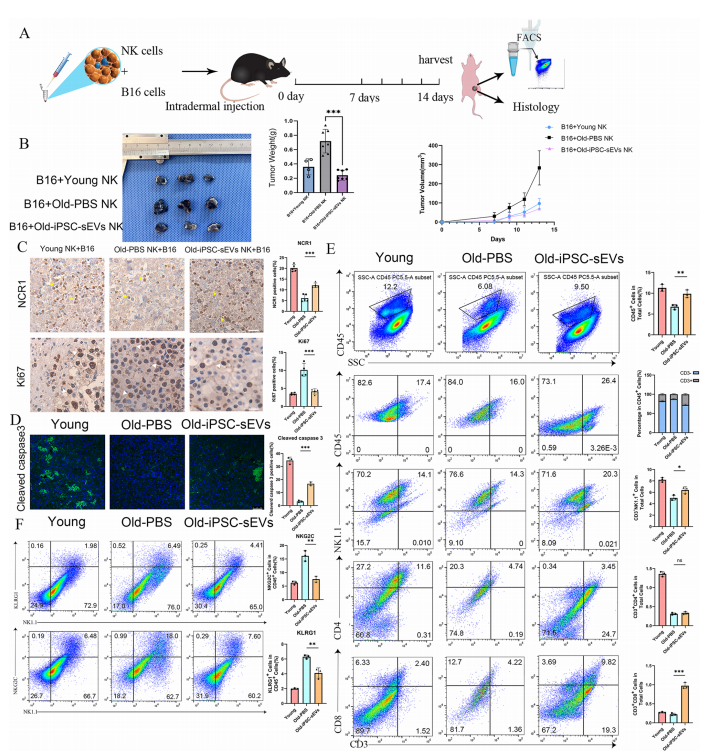
在体内共接种模型中,iPSC-sEVs改善了NK细胞的衰老,增强了衰老NK细胞的细胞毒功能。
最后,研究团队通过质谱分析发现,iPSC-sEVs内富含大量RNA结合蛋白(RBPs)。这些蛋白可能通过调控CISH mRNA的稳定性或降解,实现对其表达的负向调节。这一发现为iPSC-sEVs的作用机制提供了分子层面的解释。
结论
该研究不仅阐明了iPSC-sEVs通过CISH-STAT3轴逆转NK细胞衰老的新机制,更凸显了其作为一种基于iPSC的创新策略在老年肿瘤免疫治疗中的巨大潜力。值得关注的是,基于iPSC的治疗体系远不止于此——以iPSC衍生功能细胞为核心的细胞疗法,已成为全球再生医学中临床进展更快的核心方向,并在多个疾病领域构建起丰富的研发管线。
iPSC-iMSC的3D细胞规模化破局
近期,在Stem Cell Research & Therapy期刊上发表的题为:A scalable platform for EPSC-Induced MSC extracellular vesicles with therapeutic potential 的文章中,相关研究团队便就建立稳定、高效的iMSC的扩增体系展开研究,并初步探索了由其衍生的细胞外囊泡(iMSC-EV)规模化生产方式,为推进iMSC技术向临床转化提供了重要的平台支持。
随着诱导多能干细胞(iPSC)技术的发展,大量实验数据证明,相较于传统MSC,由iPSC分化的MSC(iMSC)具备无限扩增、同质性高、易基因修饰等优势,为MSC类细胞产品提供了理想来源。而要将这些先天优势转化为临床可用、可规模化拓展的MSC药物生产平台,构建稳定高效的规模化生产工艺至关重要。
技术路线
该研究成功建立了一条从诱导多能干细胞(iPSC)出发,经由拓展多能干细胞(EPSCs)及滋养层干细胞(TLCs),最终高效定向分化为间充质干细胞(iMSCs)的创新路径。该体系在方法与诱导策略上实现了重要突破,为iMSCs的稳定获取奠定了坚实基础。
建立EPSC诱导MSC及EVs的规模化制备体系:研究团队优化了EPSC定向分化为功能性MSC的诱导条件,设计了适配工业化生产的培养工艺(如无血清悬浮培养、生物反应器扩增),实现了MSC的高效增殖;同时开发了标准化的EVs分离纯化方法(如超滤离心结合尺寸排阻色谱),大幅提升EVs产量且保证其批次稳定性。
验证EPSC诱导MSC-EVs的生物学特性:通过蛋白组学、脂质组学分析发现,该EVs富含与组织修复、免疫调控相关的关键分子(如生长因子、microRNA),其核心功能组分与原代MSC-EVs高度相似,且在体外实验中展现出促进细胞增殖、抑制炎症因子分泌的活性。
最终获得的iMSCs不仅完全具备原代MSCs的核心特性与功能,更展现出显著优于后者的增殖能力与长期稳定性。流式细胞术及三系分化实验证实,iMSCs具有标准的MSC表型和多向分化潜能,符合细胞治疗产品的质量要求。尤为关键的是,在与原代脐带来源MSC(UC-MSCs)和脂肪来源MSC(ADSCs)的直接比较中,iMSCs在更高代次下仍能维持更稳定的表型、正常的核型以及持续的增殖活力。这一卓越特性完全满足作为细胞治疗产品和制备EVs的质量要求,为其实现临床级规模化应用提供了决定性优势。
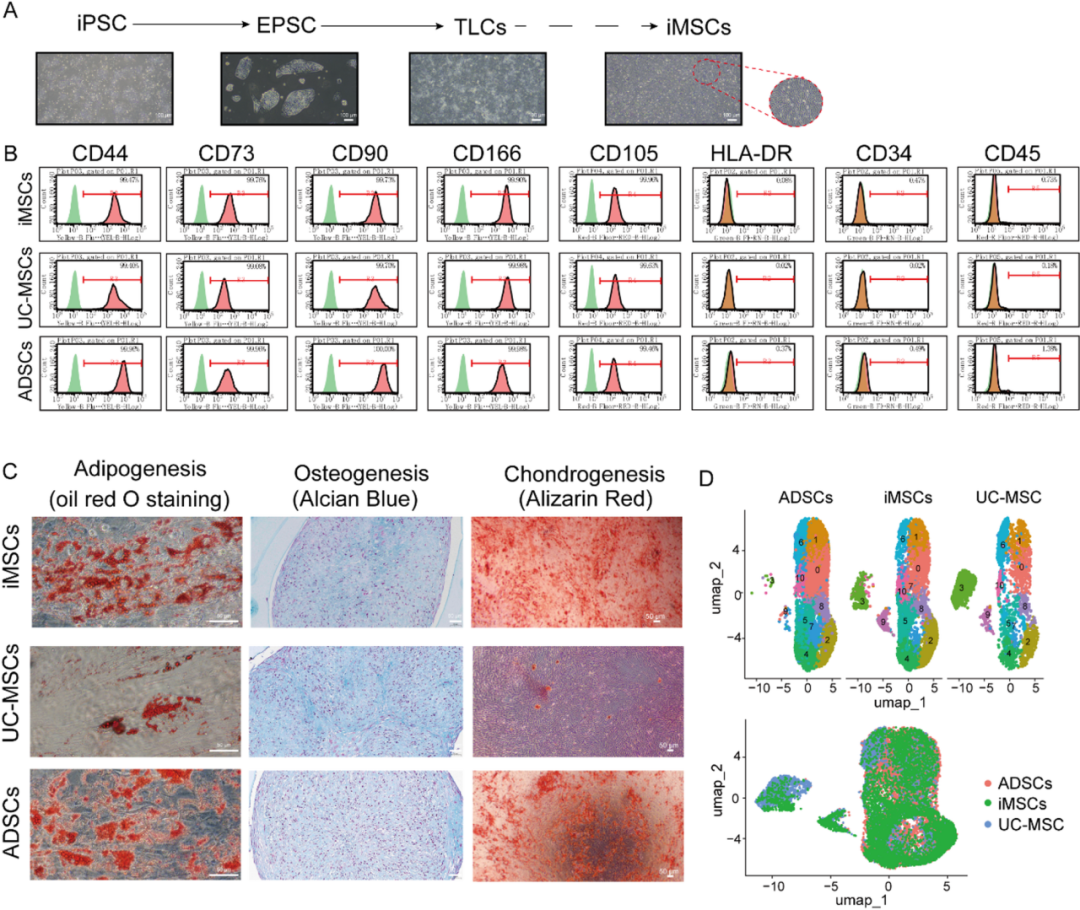
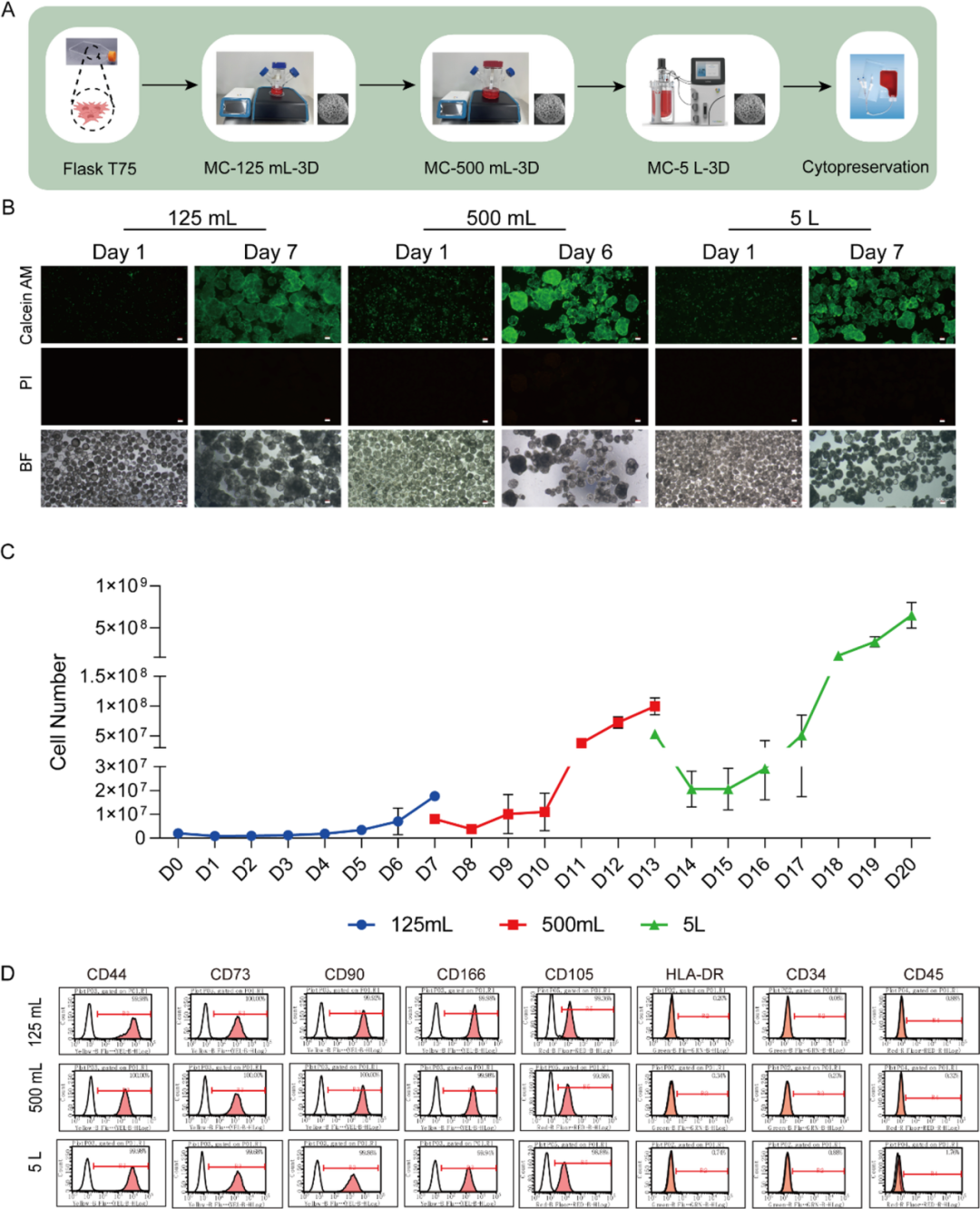
从iPSCs分化到拓展多能干细胞(EPSCs)、滋养层干细胞(TLCs)以及最终iMSCs的示意图(比例尺:100 μm)
在EPSCs诱导阶段,细胞展现出显著优于iPSCs和H9细胞的TLCs分化潜能。通过相差显微镜观察、定量PCR及免疫荧光分析验证,隆起饱满的EPSCs形态已逐渐转变为MSCs特征的纺锤形、成纤维细胞状,且关键滋养层标志物表达水平更高,多能性标志物OCT4的表达模式也符合定向分化的预期,充分表明其处于更利于向TLCs分化的状态。
EPSC诱导的具有治疗潜力的MSC细胞外囊泡的可扩展平台
在扩增过程中,iMSCs表现出良好的适应性与增殖潜力。细胞在反应器内维持较高活性,并形成典型的3D细胞聚集体。通过进一步对细胞数量的动态监测显示,培养前三天细胞数量出现短暂下降,这一现象可能是由于细胞处于附着微载体、适应生物反应器环境的适应阶段;自第四天起,iMSCs进入快速增殖期,分别在培养第6天(500 mL反应器)与第7天(125 mL及5 L反应器)达到峰值数量,实现单批次细胞产量从5.5×10⁷提升至5×10⁸,增幅近10倍。
结论
该研究构建iPSC定向分化iMSCs的创新路径,所得iMSCs性能优于传统原代MSC;依托3D微载体与自动化生物反应器,实现iMSCs从125mL到5L的高效规模化扩增,细胞特性稳定。同时完成iMSC-EV的规模化制备与纯化,其在小鼠肺纤维化模型中疗效显著。研究突破iMSC规模化生产瓶颈,为相关细胞药物及EV产品的临床转化与产业化奠定关键基础。
总结
综上,两项研究从不同维度推动了iPSC相关技术在再生医学领域的发展。前者揭示了iPSC-sEVs逆转NK细胞衰老的全新机制,为老年肿瘤免疫治疗提供了创新策略,破解了老龄化背景下免疫功能衰退的核心难题;后者则突破iMSC规模化生产瓶颈,建立了高效稳定的扩增与iMSC-EV制备平台,解决了传统MSC临床转化的产能与均一性痛点;为再生医学攻克疑难病症、守护人类健康注入了强劲动力,也彰显了我国在该前沿赛道的研究实力与发展潜力。