
来源:BioArt
多年来,科学家一直在研究造血干细胞(Hematopoietic stem cells, HSCs),但迄今为止,尚未成功开发出无载体且可移植的HSC。与此相反,许多可用于治疗疾病的血细胞,如红细胞、B细胞、T细胞、骨髓细胞、巨核细胞和造血组细胞,可以通过人胚胎干细胞(human embryonic stem cells, hESCs)或人诱导多能干细胞(human induced pluripotent stem cells, hiPSCs)生产出来。最近的研究主要集中在从多能干细胞中获得与临床移植中使用的成人HSCs相似的CD34+ CD45+细胞群,但是这些细胞在免疫抑制小鼠中的移植能力有限,限制了其在治疗中的应用。至今唯一一项成功生成真正HSCs的研究受到编码癌基因的质粒或滋养层细胞存在的限制,无法实现临床应用。有趣的是,从畸胎瘤中可以获得具有可移植性的HSCs,这表明从多能干细胞中生成HSCs是可能的。实际上,在胚胎发育过程中,主动脉-性腺-中肾(aorta-gonad-mesonephros,AGM)区域的内皮细胞也可以生成可移植的HSCs,这些细胞通过内皮-造血转化(endothelial-hematopoietic transition,EHT)的形成来模拟胚状体(embryoid body, EB)中的造血发育过程。
2023年12月7日,来自法国血液中心EFS的Thierry Jaffredo与巴黎索邦大学的Laurence Guyonneau-Harmand共同在Cell Stem Cell期刊发表题为Generation of transgene-free hematopoietic stem cells from human induced pluripotent stem cells(利用人类诱导多能干细胞生成无转基因的造血干细胞)的文章。研究人员成功地开发了一种单步培养系统,通过hiPSCs可获得无载体和无基质的HSCs。这些HSCs经移植到小鼠骨髓后,能够定居并形成多系造血细胞群体,并能够连续移植。研究显示,重建的HSCs在转录水平上与人类胚胎主动脉来源的HSCs相似。这一研究结果对于深入理解HSCs的生成机制具有重要意义。

HSCs是造血细胞(Hematopoietic cell, HC)移植中具有终身治疗效果的稀有细胞。近年来患者对HSCs的需求显著增加,使HSCs移植面临重大挑战。研究人员希望从hiPSCs中开发一种无载体和无基质的体系,生成从具有强大的、长期的多重潜能再构和自我更新能力人类HSCs。这一想法很有希望,但目前尚未实现。
培养条件的建立
首先,通过实验设计方法,研究人员确定了十种细胞因子和生长因子的组合。他们评估了细胞扩增、长期培养启动细胞(long-term culture-initiating cells,LTC-ICs)频率以及细胞表面标记物的表达等指标,确定了三种有效的组合。三种组合用于hiPSCs细胞系分化的研究结果发现,组合A表现出最佳的未成熟和成熟造血标记物比例。在NOD/SCID小鼠中,组合A产生了最高比例的人类CD45+细胞。因此,研究人员选择了组合A进行后续研究和应用。
hiPSCs分化细胞的特征和功能表征
研究人员将hiPSCs分化为CD34+CD45+血管内皮细胞,并将其移植到小鼠体内以评估其再建造血潜力。结果表明,移植的细胞能够成功再建造血,类似于使用脐血中的CD34+细胞进行移植的效果。移植后20周,小鼠骨髓内产生了多种人类血液细胞,如髓系、B细胞和T细胞,整体呈现出良好的多系分化。此外,研究还证实了移植细胞在周边血液循环中的存在,表现出与脐血移植接受者外周血中相似的多系模式。总之,研究结果表明通过hiPSCs的分化可以有效实现血细胞再建。接下来,研究人员对移植到小鼠骨髓中的细胞进行了分析和功能验证。研究发现移植后小鼠骨髓中存在多种类型的人类细胞,如红细胞、B细胞、T细胞等。功能验证表明移植细胞表现出正常的血液细胞特性,如血红蛋白切换、T细胞激活和增殖。血液祖细胞分析证实存在功能性的人类造血干细胞,并通过二次移植实验证实了其持续再造能力。进一步的实验证明,从EB细胞后代获得的人类造血干细胞展现出强大的自我更新潜力,并且能够稳定再生多种细胞。这些研究结果揭示了通过细胞移植实现血细胞再建的潜力。
EBs模拟HSCs发育过程分析
通过转录组分析和单细胞RNA测序(scRNA-seq),研究人员对通过EBs模拟HSCs的发育过程进行了追踪。他们观察到在培养的不同时间点,EBs中存在着27种不同类型的细胞,分布在三个主要分支中,对应于外胚层、中胚层和内胚层,以及包含滋养层细胞祖细胞谱系的第四个分支。研究人员重点关注了内皮和血管HC细胞群,并将其与人类胚胎的scRNA-seq数据进行比对。他们发现分化过程产生了类似于胚胎主动脉和静脉内皮细胞的细胞群,证明了这一分化过程能够模拟HSC的发育。通过对MYB和RUNX1基因表达模式的研究,以及对内皮标志物CD34和CDH5的流式细胞分析,研究人员进一步验证了这一过程。研究还发现EB周围存在着密集的血管网络,可能存在一种从内皮细胞向HSC转化的过程。最后,研究人员通过六基因标志物和HSCs的评分,鉴定了产生HSC的亚群,并发现候选HSC亚群的表型介于AGM早期和成熟HSC之间。因此,通过对EBs的分子和表型鉴定,证明了这种体外培养过程可以重现人类HSC的发育,并提供了关于内皮和HSC细胞群的详细观察和分析。
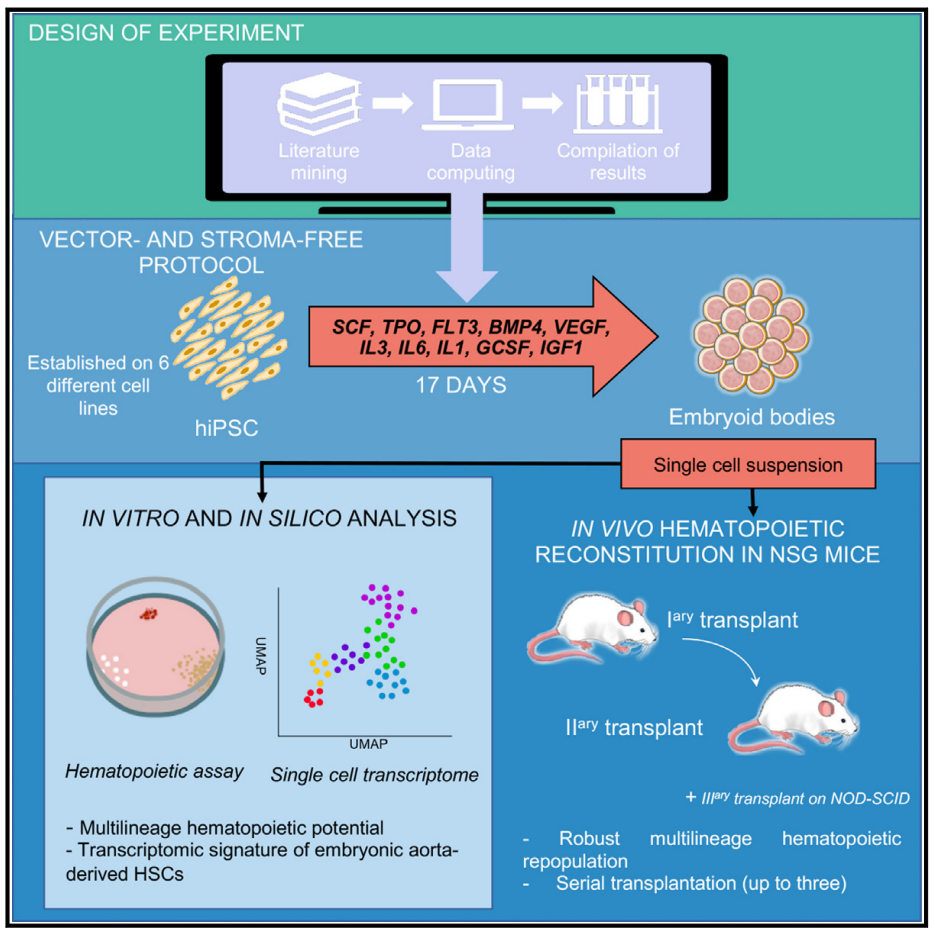
综上所述,该研究开发了一种无载体和无基质体系,从hiPSCs中产生具有强大、长期的多潜能再构和自我更新能力的人类HSCs的方法。该方法使用EB形成产生细胞群,其类似于早期在人类胚胎AGM区域中发现的未成熟HSCs。这说明生成无载体和无基质的人类HSCs是可以实现的,而且可以通过产生更接近于发育过程中出现的原始HSCs细胞来实现。
原文链接:https://doi.org/10.1016/j.stem.2023.11.002