
诱导多能干细胞(induced pluripotent stem cells,iPSC)重编程的过程涉及几个关键事件,包括体细胞基因关闭、多能基因激活,间质上皮转化(mesenchymal–epithelial transition,MET),代谢重编程,和表观遗传重塑。尽管这些事件错综复杂地相互作用并相互影响,但调节重编程网络的具体因素尚不清楚。双同源结构域蛋白(Double homeobox,Dux)是一种已知在胚胎干细胞(Embryonic stem cell,ESC)向2C样胚胎干细胞(2-cell like cells,2CLC)过渡过程中促进全能性的因子,但在iPSC重编程的背景下尚未得到广泛研究。组蛋白第18位赖氨酸乳酸化修饰(H3K18la)受到糖酵解代谢产物的影响,是一种转录激活型修饰,能够在染色体水平上调控基因表达、影响细胞命运,是连接遗传信息和环境因素的桥梁。
2024年3月15日,哈尔滨医科大学基础医学院组胚教研室雷蕾教授课题组在Nucleic Acids Research 期刊上在线发表了题为“Dux activates metabolism-lactylation-MET network during early iPSC reprogramming with Brg1 as the histone lactylation reader”的研究论文【1】,在这项研究中证明了iPSC重编程过程中Dux-H3K18la-MET调控网络。
Dux通过影响代谢产物和调控组蛋白修饰酶,影响H3K18la水平。此外,该研究对基于H3K18la免疫沉淀实验的蛋白质组学分析揭示了重编程过程中Brg1的特异性招募,H3K18la和Brg1都富集在与多能性和上皮连接相关的基因启动子上。通过蛋白互作和分子对接证明其作为组蛋白乳酸化阅读器的角色。该研究有助于进一步理解完善组蛋白乳酸化修饰调控生物学过程的作用机制。

Dux在胚胎发育中的作用近年来受到了极大的关注,因为它能够促进ESCs转化为具有增强发育潜能的全能性干细胞。在小鼠胚胎发育过程中,Dux mRNA在早期2-细胞阶段表现出特异性的高转录水平,这与合子基因组激活( ZGA )第一波的启动相吻合。虽然已经证明Dux对于ZGA来说并不是不可或缺的,但有证据表明它在2CLCs的转变过程中起着至关重要的作用。2CLCs是ESCs的一个亚群,表现为小鼠2 -细胞胚胎特异性基因和重复序列的自发表达。与ESC相比,2CLCs具有更高水平的H3K27ac、H3K4me3、H3K4me1修饰。此外,与ESC相比,2CLCs具有更全面的多能性,因为它们不仅对所有3个胚层都有贡献,而且在嵌合体实验中也对滋养外胚层( TE )有贡献。先前的报道表明,2CLCs的转变是由Myc和Dnmt1的下调启动的,导致Dux表达增加。此外,2CLCs状态的退出是由Smg7/Upf1对Dux mRNA的抑制启动的。这些发现强调了Dux在全能性获得中的重要作用。
此外,Dux对体细胞核移植( SCNT )重编程的推进也有重要贡献【2】。Dux通过提高H3K9ac和H3K27ac修饰来增强2 -细胞SCNT胚胎中ZGA基因的表达,从而导致更高的植入前和植入后发育率。Dux蛋白的N端由两个高度保守的相邻DNA结合同源结构域组成,而Dux的C端招募CBP/p300,有利于组蛋白H3乙酰化的积累。促进组蛋白H3乙酰化在先前已经被确立为提高iPSC重编程效率的一种手段。有研究表明,Duxbl促进肌肉干细胞的MET,这是iPSC重编程早期的关键步骤。此外,已知促进2CLC的其他特征基因也被发现通过促进H3酰化或代谢重排来增强iPSC重编程。因此,作者提出假设,Dux可能在促进iPSC重编程中发挥作用,尤其是在重编程的起始阶段。iPSCs的建立需要将分化的体细胞重编程为多能性状态。虽然Yamanaka因子具有重编程所有分化的体细胞的潜力,但重编程过程的顺利完成需要以顺序或同时的方式发生多个事件。因此,相当一部分细胞不能完成重编程,而被困在重编程的初始阶段,导致重编程效率降低。
传统的iPSCs重编程过程包括在不同调控水平上运行的各种关键事件。在染色质水平,重编程早期与成纤维细胞相关的许多特定开放位点迅速关闭,而与多能性相关的许多位点在后期变得开放。在表观遗传水平上,存在整体基因组甲基化水平的降低,同时伴随着组蛋白H3和H4乙酰化水平的逐渐升高。在转录水平上,在第1个转录波中,体细胞相关基因显著减少,随后在第2个转录波中,多能性相关基因显著增加。在代谢水平上,初级供能途径存在由体细胞普遍利用的氧化磷酸化( OXPHOS )向干细胞偏好的有氧糖酵解的转变。这种转变被称为OXPHOS到糖酵解转变( OGS )。在形态学水平上,细胞经历MET过程,即从成纤维样细胞向上皮样细胞转化。这种转化伴随着显著的基因表达变化,特别是细胞粘附分子如Cdh1,也被称为E - cadherin。因此,研究人员推测在重编程的初始阶段存在一个基本的因素,它推动干细胞相关过程向多能性的方向发展。
表观遗传调控包括多种重要机制,其中组蛋白翻译后修饰( PTM )具有重要意义。具体来说,组蛋白乙酰化修饰被广泛研究,被认为通过抵消赖氨酸侧链上的正电荷或招募特定的阅读器蛋白来促进转录。除Dux外,学术界一致认为代谢物具有影响组蛋白翻译后修饰程度的能力。其中一种代谢产物是乳酸,它是糖酵解的主要产物。乳酸-CoA,可以作为组蛋白修饰的底物,从而调节DNA分子的可及性,进而调节基因表达【3】。研究表明,H3K18la在调节转录元件的分布中起着至关重要的作用,特别是在组织特异性基因的增强子中。
许多公认的组蛋白修饰酶,如p300,作为乳酰基转移酶负责组蛋白乳酸化。当存在经典的HDAC1 - 3和SIRT1 - 3酶时,可以观察到组蛋白赖氨酸乳酸化,特别是H3K18la和H4K5la减少,表明这些经典的I型HDACs在体外可以作为赖氨酸乳糖化的有效"擦除器"。然而,对于乳糖化修饰的"读者"的鉴定在文献中仍未见报道。组蛋白乙酰化和去乙酰化的识别过程涉及3个主要结构域:溴结构域( BD )、双PHD指( DPF )结构域和YEATS结构域。BD模块以其保守性而闻名,与组蛋白上乙酰化的赖氨酸残基结合。鉴于溴结构域同源蛋白之间结合的保守性,以及组蛋白乳酸化与组蛋白乙酰化在结构、功能和进化上的相似性,有理由推测含有BD模块的蛋白也可以作为组蛋白乳糖基化的"阅读器"。
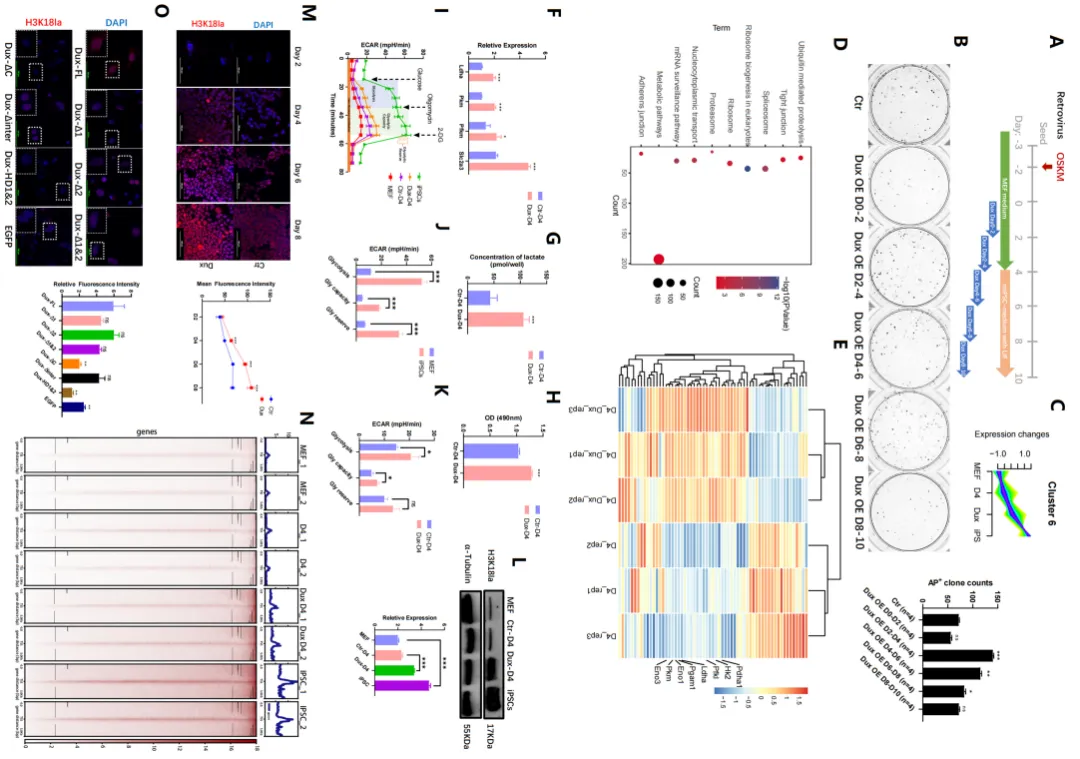 Dux通过代谢重塑促进iPSCs重编程效率(图源自Nucleic Acids Research )
Dux通过代谢重塑促进iPSCs重编程效率(图源自Nucleic Acids Research )
基于此,研究人员发现瞬时过表达Dux通过上调H3K18la水平导致iPSC重编程效率的增强。该研究在重编程的初始阶段通过H3K18la建立了OGS、组蛋白乳酸化和MET之间的联系,突出了H3K18la在成功重编程中的关键作用。具体来说,Dux通过促进OGS并利用其C端招募p300来促进H3K18la水平的增加。随后,Brg1与H3K18la相互作用,H3K18la富集在MET相关基因的启动子上,充当乳酸化的阅读器,以促进重编程过程。
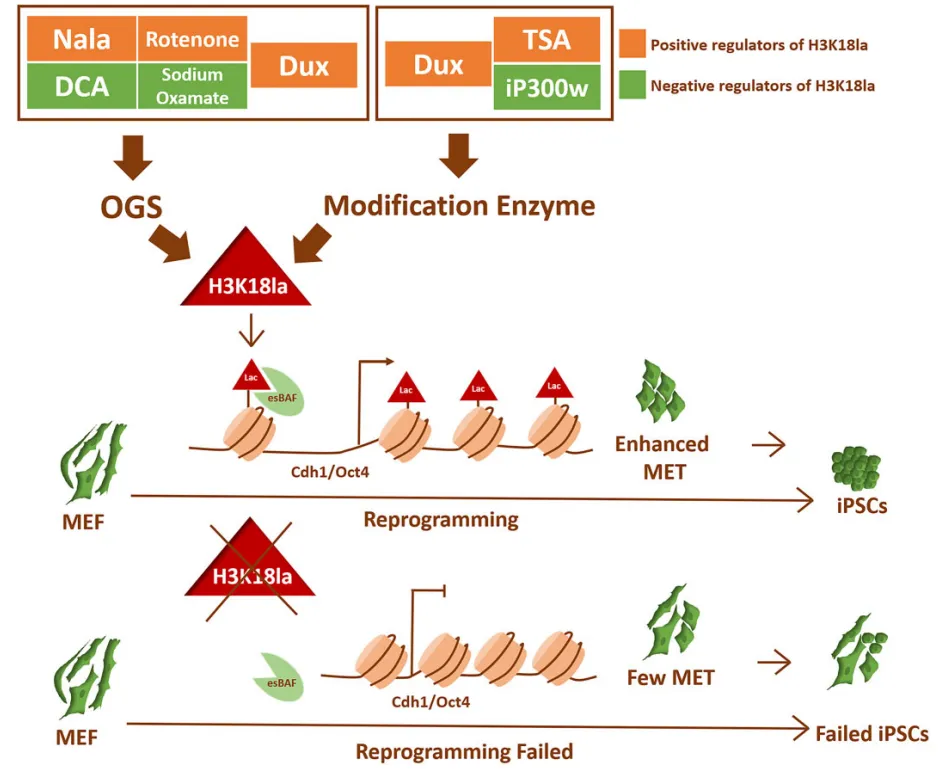 Dux通过代谢重塑促进iPSCs重编程效率(图源自Nucleic Acids Research )
Dux通过代谢重塑促进iPSCs重编程效率(图源自Nucleic Acids Research )
哈尔滨医科大学雷蕾教授、吴嫣爽副教授,中国科学院广州生物医药与健康研究院吴光明研究员为文章共同通讯作者,哈尔滨医科大学胡兴琳、黄星卫为文章共同第一作者。
参考文献:
【1】Hu X, Huang X, Yang Y, Sun Y, Zhao Y, Zhang Z, Qiu D, Wu Y, Wu G, Lei L. Dux activates metabolism-lactylation-MET network during early iPSC reprogramming with Brg1 as the histone lactylation reader. Nucleic Acids Research, 2024,
【2】Huang X, Hu X, Jiang Q, Cao Q, Wu Y, Lei L. Functional study of distinct domains of Dux in improving mouse SCNT embryonic development dagger. Biol Reprod, 2021
【3】Zhang D, Tang Z, Huang H, Zhou G, Cui C, Weng Y, Liu W, Kim S, Lee S, Perez-Neut M, Ding J, Czyz D, Hu R, Ye Z, He M, Zheng YG, Shuman HA, Dai L, Ren B, Roeder RG, Becker L, Zhao Y.Metabolic regulation of gene expression by histone lactylation. Nature, 2019