
2024年3月28日,知名学术期刊《Adv Healthc Mater》上,刊载了东南大学公共卫生学院王适之副教授团队,开发的一种“干细胞外泌体治疗骨关节炎的新方法——CAP-exoASO”的相关报道。
研究显示,CAP-exoASOs在治疗骨关节炎方面,可获得令人满意的疗效,具有巨大的开发潜力!这一研发成果的发表,瞬间引爆了关于干细胞外泌体的讨论。其实,除了骨关节炎外,外泌体在治疗椎间盘退变、肌腱撕裂、骨质疏松等其他骨与关节疾病方面,也“大展拳脚”,为饱受疼痛和疾病困扰的骨病患者,带来了新的希望与选择!
CAP-exoASO:骨关节炎患者的“新曙光”!
东南大学团队本次研究的新方法,通过使用转肽酶SortaseA,将小细胞外囊泡(exos)与软骨细胞亲和肽(CAP),随后构建并获得软骨细胞靶向药物递送exo(CAP-exoASO)。与传统不含CAP的外泌体(ExoASO)相比,CAP-exoASO在治疗骨关节方面,具有如下优势:
1、可减轻IL-1β诱导的软骨细胞损伤,通过降低MMP13(基质金属蛋白酶13)表达、上调COL2A1表达,从而导致软骨基质重组、减轻骨关节炎进展。
2、可通过抑制TNF、IL-17的信号通路,来减轻炎症。
3、可延长ASO-MMP13在关节内的保留时间,且关节内注射CAP-exoASO后,该药可直达病变部位,而不会分布在主要器官中。
综上,CAP-exoASOs基于靶向递送效应,成功地完成了软骨修复,在治疗骨关节炎方面,具有广阔的应用前景,未来可期!
何谓干细胞外泌体?它的作用与“前世今生”
干细胞来源的外泌体(SC-Exo)是干细胞分泌的一种纳米级(直径小于150nm)、球形的细胞外囊泡(EV)。携带脂质、蛋白质、碳水化合物、核酸等多种大分子,在细胞通讯中发挥着重要作用,可协调功能蛋白、代谢物和核酸向受体细胞的转移。
外泌体最初由沃尔夫博士,在半个世纪前于血浆中观察到,从那时起,研究表明所有检查的生物液体中都存在囊泡,并且体外培养的细胞系已表现出不同程度的囊泡释放。1987年,Rose Johnstone博士将其正式命名为“外泌体”。
外泌体不仅继承了与干细胞类似的治疗效果,比如免疫反应、组织修复等。同时,还具有自身独特的优势,一方面,其免疫原性较低,这使它们作为治疗载体更具吸引力;另一反面,其尺寸娇小同时具有膜成分,使它们能够穿越主要的生物屏障(如血脑屏障等)。故而,外泌体可被设计为治疗剂,用于治疗骨关节疾病、心血管疾病、神经退行性疾病、糖尿病等多种慢性疾病。
外泌体的来源和分类
外泌体存在于所有体液中,如血液、血浆、唾液、羊水、尿液等。按照分类方式不同,外泌体可分为如下类型:
-PART 1-按是否经过人工修饰分类
根据外泌体是否经过人工修饰,可将外泌体分为两类,即天然外泌体、工程外泌体。
-PART 2-按亲代细胞类型分类
几乎所有类型的人类细胞都可以产生外泌体,这些包括但不限于巨噬细胞、树突状细胞(DC)、干细胞、血小板等,其分类不同,具体作用也有所差异。
1、巨噬细胞衍生的外泌体:在治疗炎症性肠病、皮肤伤口、真菌及病毒感染等方面,具有一定的效果。
2、树突状细胞(DC)衍生的外泌体(Dex):可通过其表面蛋白[如主要组织相容性复合物(MHC)],与免疫细胞(如NK细胞、B细胞、T细胞)相互作用。
3、干细胞衍生的外泌体:其在美容抗衰、慢病防治(比如肌肉骨骼疾病、退行性疾病、神经系统疾病、免疫疾病)、改善亚健康等方面,具有广阔的应用潜力,也是目前临床应用较多的一款。
干细胞外泌体剑指多款骨关节疾病
-PART 1-治疗骨关节炎
骨关节炎是一种由年龄、炎症、外伤、劳损等多种因素引起的退行性关节疾病,病变不仅影响整个关节,还会累及骨、肌肉、滑膜、韧带和关节周围脂肪等,其典型表现为关节软骨损伤、关节边缘骨质增生、骨赘形成,严重影响患者的生活质量。本病多见于中老年及肥胖人群,而且随着人口老龄化、生活方式的改变以及中年人口的逐渐增加,骨关节炎的发病率正在急剧上升。
目前,临床主要通过局部外用药物、关节腔内注射药物(如糖皮质激素、玻璃酸钠等),来短期镇痛和抗炎。然而,关节软骨的退化是无法避免的,若逐渐恶化,可能需要进行关节融合或人工关节置换等外科手术。然而,这些手术可能存在创伤较大、术后活动受限、金属假体相关感染等副作用。
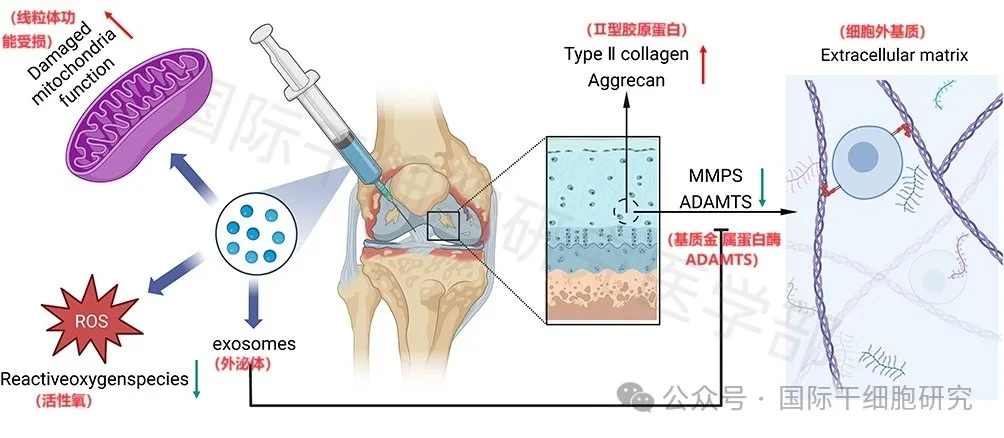
因而,迫切需要探索一种治疗骨关节炎的新方法,以预防其发作并减缓疾病进展,近年来,干细胞外泌体作为骨关节炎的潜在治疗方法,引起了广泛关注。临床主要应用间充质干细胞(MSC)衍生的外泌体,这些间充质干细胞可能来源于牙龈、牙髓、骨髓、滑膜、髌下脂肪垫等多种组织。研究发现,外泌体主要通过以下机制治疗骨关节炎:
1、间充质干细胞(MSC)衍生的外泌体,可通过OA中的lncRNA-KLF3-AS1/miR-206/GIT1轴,促进软骨细胞增殖、抑制软骨细胞凋亡。
2、MSC来源的外泌体,在体外抑制炎症因子、谷氨酰胺代谢活性相关蛋白、谷氨酰胺及GSH/GSSG比值,同时改善软骨细胞的功能、组织炎症以及运动能力,从而有助于缓解骨关节炎的进展。
3、来自软骨形成MSC的外泌体miR-92a-3p,可通过靶向Wnt5a,增强软骨形成、抑制软骨降解。
4、滑膜MSC衍生的外泌体miR-320c,可通过靶向ADAM19,来增强软骨形成。
5、牙龈MSC衍生的外泌体,被证明具有免疫抑制作用,可预防胶原诱导的关节炎。
图1 外泌体促进软骨修复的分子机制
-PART 2-肌肉和肌腱撕裂
肌肉和肌腱撕裂可能是由急性创伤(如骨折)或慢性过度使用(如运动损伤)等引起。肌肉拉伤和肌腱撕裂的愈合,包括炎症、增殖、重塑阶段等过程。研究显示,间充质干细胞(MSC)衍生的外泌体,有利于促进肌肉和肌腱撕裂的愈合,主要原因如下:
1、外泌体可改善C2C12成肌细胞的体外肌生成、HUVEC(人脐静脉内皮细胞)的血管生成,同时在心脏毒素诱导的肌肉损伤模型中,加速体内骨骼肌再生。
2、外泌体可预防肌肉萎缩、炎症和血管化,防止脂肪浸润,并改善生物力学特性;此外,外泌体(尤其是骨髓间充质干细胞衍生的外泌体)可增加重建后肩袖的断裂载荷和刚度,诱导肩袖端点周围的血管生成,并促进肌腱-骨界面的生长,从而改善慢性肩袖撕裂。
-PART 3-骨折
骨折愈合涉及合成代谢组织膨胀阶段、分解代谢组织重塑阶段,该阶段受干细胞、先天性和适应性免疫功能、稳定性等多种因素控制。研究显示,外泌体也有助于促进骨折的愈合,原因如下:
1、骨修复的进展需要多种细胞,如炎症阶段的炎症细胞、纤维血管阶段的内皮及间充质祖细胞、骨形成阶段的成骨细胞和软骨细胞、骨痂重塑阶段的破骨细胞。这些细胞大多可摄取外泌体,特别是成骨细胞和血管内皮细胞,从而有助于骨折的愈合。
2、外泌体吸收后,受体细胞的基因表达发生改变,从而激活各种信号通路,引起各种细胞和组织反应,最终利于骨折愈合。
-PART 4-椎间盘(IVD)退变
椎间盘(IVD)退变是导致腰痛的主要原因,其分子过程包括细胞外基质(ECM)变性、炎症、氧化应激、细胞凋亡、衰老、自噬减少等。研究显示,外泌体也有助于改善椎间盘退变、缓解由此而产生的腰痛,原因如下:
1、椎间盘内注射干细胞外泌体,有助于通过外泌体miR-21,抑制髓核细胞(NPC)凋亡,并减轻IVD变性。
2、外泌体可通过传递miR-302c,抑制NLRP3炎性体,从而减轻髓核细胞的焦亡。
3、MSC衍生的外泌体,还可抑制NPC中的氧化应激,最终有助于改善椎间盘退变。
-PART 5-骨质疏松症
骨质疏松症是一种代谢性骨病,其特征是骨密度低和骨结构弱化,从而增加骨折的风险,主要因破骨细胞的骨吸收,被成骨细胞的骨形成补偿不足所致。研究显示,外泌体也有助于改善骨质疏松症的原因如下:
1、外泌体可以拮抗缺氧/血清剥夺诱导的骨细胞凋亡,骨细胞介导的破骨细胞生成。
2、通过miR-1263/Mob1/Hippo途径,抑制骨髓间充质干细胞凋亡,从而预防废用性骨质疏松症。
3、通过miR-2110、miR-,改善骨密度,并逆转雌激素缺乏所致的骨质疏松症。
-PART 6-股骨头坏死
“股骨头坏死(ONFH)”又被称为“股骨头缺血性坏死”,可由创伤(如股骨头颈骨折)、非创伤因素(如长期使用肾上腺糖皮质激素)等因素所致,其中糖皮质激素(GC)是导致股骨头坏死的常见原因之一,其发病可能与股骨头血液供应受损、成骨活性减弱等有关。股骨头坏死临床以全髋关节置换术等手术治疗为主,症状较轻者也可给予低分子肝素等药物,改善症状。
近年研究发现,干细胞外泌体可通过PI3K/Akt途径,促进血管生成和骨生成,从而预防由糖皮质激素诱导的股骨头坏死。
国内外干细胞外泌体疗法的临床应用及研究
1、外泌体疗法治疗骨关节疾病的临床试验(截至2024年4月)
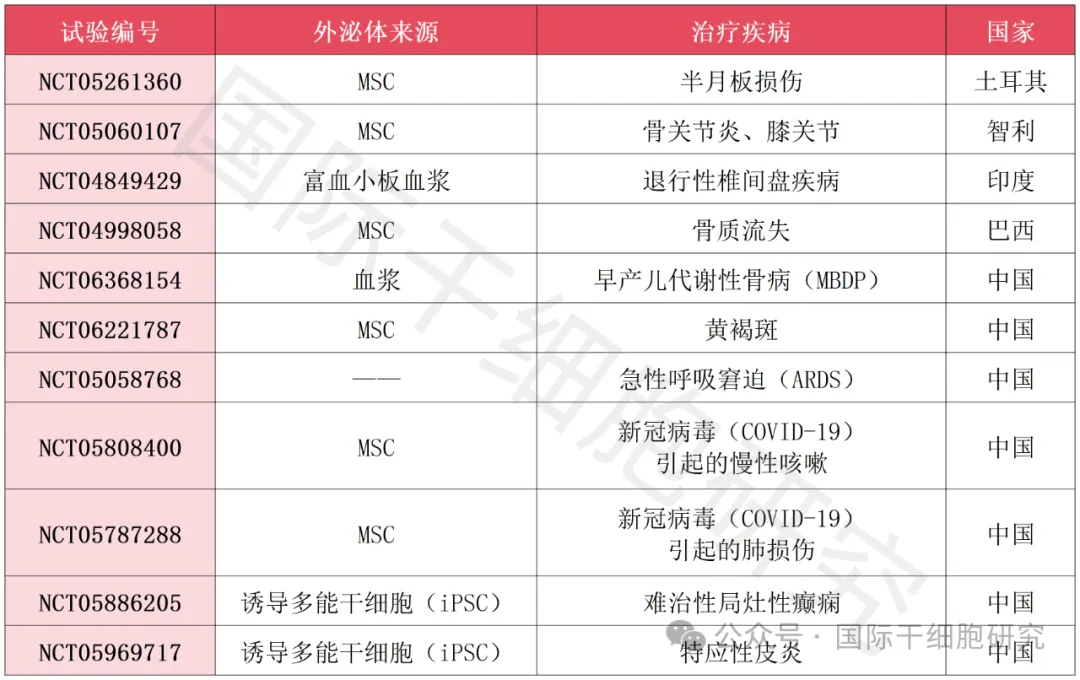
▲数据源自“ClinicalTrials.gov”,国际干细胞研究医学部整理
2、日本获批的干细胞外泌体项目
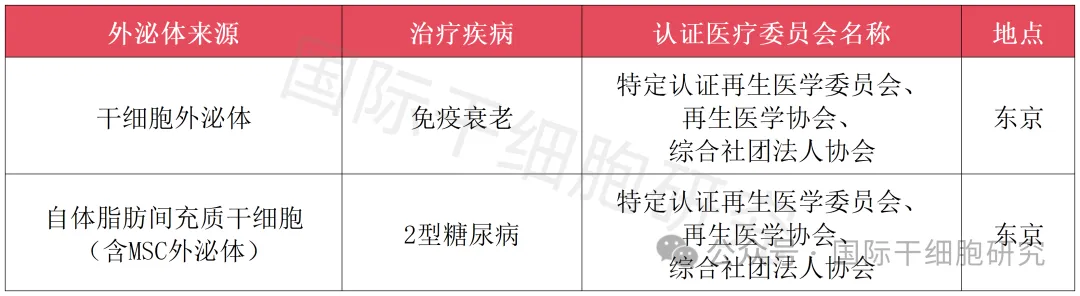
▲数据源自“e-再生医療”,国际干细胞研究医学部整理
小编寄语
随着再生医学的不断发展,除了干细胞本身外,干细胞的衍生品(比如干细胞外泌体、上清液等),也引起了广泛关注与讨论。研究显示,干细胞来源的外泌体在治疗骨科等多种疾病方面(如骨关节炎等),均表现出了巨大的潜力,更被视为是外科领域干细胞疗法的有效且多功能的替代品。
外泌体具有明显的优势,比如使用及储存更方便、价格更低廉等,但其治疗效力逊色于干细胞。未来如何扩大外泌体生产规模,并结合外泌体递送的多模式,以扩大干细胞衍生的外泌体,在疾病谱中的临床应用,将是各国研究的重点。总之,患者可根据自身病情、个体情况、经济状况等,咨询专业人员后,进行合理选择。