
2024年7月27日,广州实验室/广州医科大学生物医学工程学院徐涛/刘会生课题组于Nature communications杂志在线发表题为"Directed differentiation of pancreatic δ cells from human pluripotent stem cells"的文章。
该研究文章利用人多能干细胞作为起始材料,在发育的后前肠期至胰腺内胚层阶段,通过联合应用成纤维生长因子FGF7和FGF2,实现了对胰腺谱系细胞(特别是内分泌前体细胞)的高度分化维持。此方法通过激活δ细胞转录因子,促进人多能干细胞向δ细胞的高效定向分化。这一过程为再生医学和细胞治疗提供了一种潜在的δ细胞来源,有助于糖尿病等代谢性疾病的治疗研究。

人胰岛主要由α、β、δ三种内分泌细胞组成,分别分泌胰高血糖素(GLUCAGON, GCG)、胰岛素(INSULIN, INS)、生长抑素(SOMATOSTATIN, SST)。过往的研究大量集中在α和β细胞对血糖稳态的调节作用及其导致糖尿病的机制。近期的研究证据表明δ细胞在调节血糖稳态中也发挥重要功能。它能抑制α、β细胞GCG和INS的释放,并可通过旁分泌信号通路参与决定体内血糖设定点。临床上也发现δ细胞功能的缺失引起胰岛功能障碍和血糖失调。因此,δ细胞也逐渐成为受关注的糖尿病治疗潜在靶点。然而,δ细胞在人胰岛中仅占5%左右,其分离纯化困难,造成资源短缺,为研究δ细胞生理功能和药物研发带来巨大挑战。
人多能干细胞衍生的功能性胰岛α、β细胞已被证实可为基础研究和临床转化研究提供重要细胞资源并加速研究和转化的进程。但至今尚未有δ细胞的定向分化的方法。本研究基于β细胞和δ细胞发育轨迹的相似性,成功建立了一种由人多能干细胞高效定向分化为功能性胰岛δ细胞的方法,为δ细胞基础研究及糖尿病药物筛选提供重要资源。
本方法以人多能干细胞(human Pluripotent stem cell, hPSCs)为基础利用小分子诱导经历内胚层(Definitive Endoderm, DE),原肠管(Primitive Gut Tube, PGT),后前肠期(Posterior Foregut, PF),胰腺内胚层(Pancreatic Endoderm, PE),内分泌前体细胞(Endocrine Precursor, EP),未成熟胰腺细胞(Immature Endocrine Cell, IEC),成熟胰腺细胞(Mature Endocrine Cell, MEC)等时期,最终高效分化功能成熟的胰岛δ细胞。
研究过程
研究团队发现在后前肠期向胰腺内胚层分化阶段, FGF7浓度依赖性地增强胰腺前体细胞的分化效率;而延长FGF7的作用时间(胰腺内胚层-内分泌前体细胞)可以进一步增强内分泌前体细胞的分化效率。在相同分化阶段加入FGFR1的特异性激活配体FGF2,能够提升内分泌前体细胞的分化效率并特异性地促进δ细胞分化同时抑制α、β细胞的分化(HHEX及SST表达水平增高而GCG 、INS表达下降)。最终,在后前肠期-胰腺内胚层联合使用FGF7(50ng/ml)与FGF2(20ng/ml)可以显著促进后前肠期细胞向δ细胞的定向分化,其分化效率是未加FGF组的4.3倍左右(分化效率由6.9%提高至29.6%)。
免疫荧光染色及流式分选鉴定分化的δ细胞(SC-δ)表现为SST+和HHEX+并且NKX6.1-,形态学上通过透射电镜观察看到包裹SST的致密囊泡呈带状聚集在SC-δ胞质中,这些特点与成人胰岛δ细胞表型相符。随后,将分化至胰腺内分泌前体细胞和成熟的SC-δ细胞阶段的样本进行Bulk RNA-seq测序,显示FGF7与FGF2联用能够抑制肝和肠系细胞的发育(TBX3和NR5A2 下调)而促进胰腺内分泌前体细胞和δ细胞分化(PDX1和FGFR1上调)。单细胞测序分析进一步揭示干细胞衍生的SC-δ细胞与成人胰岛δ细胞的转录组近似,并且表达相关的离子通道基因。
体外和体内实验进一步证明干细胞衍生的δ细胞具有功能性。与人成熟δ细胞相似,SC-δ细胞在KCL(30mM)、高糖(20mM glucose)、K+离子通道抑制剂Tolbutamide(10mM)刺激下都能够促进SC-δ细胞分泌SST。同时,SC-δ细胞能够抑制与其共培养的β细胞的胰岛素分泌(在SSTR抑制剂CYN-154806(200nM)存在情况下INS的分泌高于未加抑制剂组的1.5倍)。胰腺δ细胞以Ca2+通道依赖的方式分泌SST,这涉及细胞外Ca2+的内流和细胞内Ca2+振荡,以响应高葡萄糖反应。因此,Ca2+峰值动态反映了δ细胞的功能成熟度。
研究团队对分化的SC-δ细胞(SST-P2A-mCherry报告系)进行了钙成像检测,发现部分细胞在高葡萄糖(20G)下表现出动态钙振荡。为了进一步研究这些细胞的体内功能,将分选的SC-δ细胞(300万/小鼠)移植到裸鼠的肾包膜中。移植6周后,通过SST和CHGA免疫染色显示,大多数SC-δ细胞仍然存活。葡萄糖耐量测试显示移植SC-δ细胞的小鼠出现一定程度的葡萄糖耐量升高,同时在葡萄糖负荷20分钟后,移植SC-δ细胞的小鼠的SST明显升高,而INS分泌减少。这些数据表明分化的SC-δ细胞在体内能够抑制β细胞的胰岛素分泌功能。
总结
本研究提供了一种由多能干细胞体外高效定向诱导分化为δ细胞的方法。通过FGF2和FGF7联合促进胰腺内分泌细胞分化及δ细胞转录激活因子的特异性表达,从而促进δ细胞的分化。本研究也进一步揭示了人成纤维细胞生长因子可能通过不同信号通路差异性地调控胰岛内分泌细胞的发育。本研究不仅为δ细胞的基础研究和糖尿病治疗药物开发提供重要资源,也将促进以胰岛细胞替代治疗为基础的糖尿病再生医学的临床转化研究。
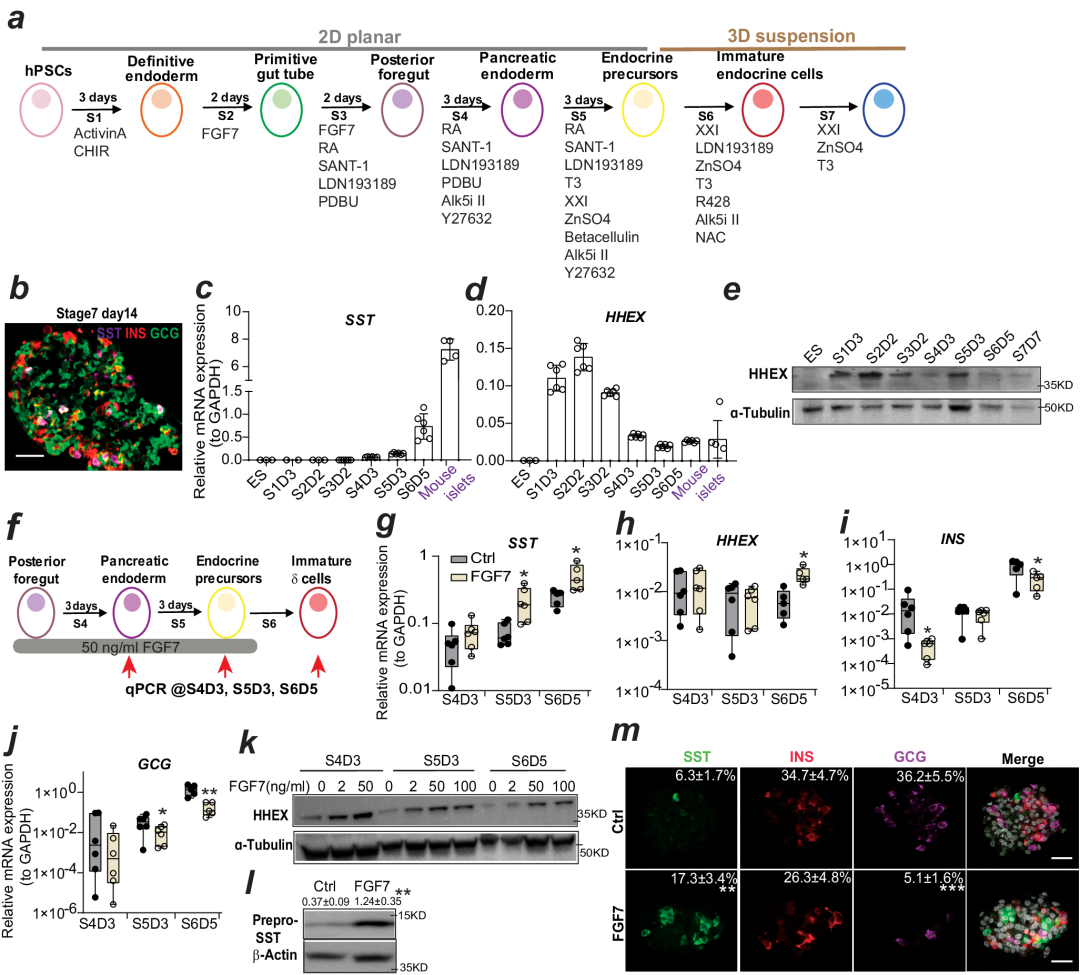
长时间的FGF7处理会诱导CST和HHEX表达,从而增加δ细胞的生成。
原文链接:https://www.nature.com/articles/s41467-024-50611-7