
再生医学浪潮翻涌,多能干细胞疗法凭借其巨大的应用潜力与不断涌现的突破性成果,正跃升为全球医疗领域最炙手可热的赛道。
近来,这一前沿领域传来振奋人心的进展 —— 不仅为难治性疾病的治疗开辟了全新路径,更给整个再生医学的发展注入了强劲动能,让攻克疑难病症的希望愈发清晰。
Cell Stem Cell发布全球首个神经发育障碍脑类器官表型图谱生物样本库
近日,美国加州大学圣地亚哥分校(University of California, San Diego)Joseph Gleeson 团队与南加州大学(University of Southern California)Lu Wang团队在Cell Stem Cell 杂志在线发表重要资源论文。
该研究依托加州再生医学研究院(CIRM)项目,构建了全球首个神经发育障碍(NDD)脑类器官表型图谱与iPSC生物样本库,整合了352例患者来源的诱导多能干细胞(iPSC)、全外显子测序(WES)、脑影像及单细胞转录组数据,系统揭示了多种神经发育障碍的细胞与分子特征。这一资源为类器官在疾病建模、机制研究和精准干预提供了新的研究基石。

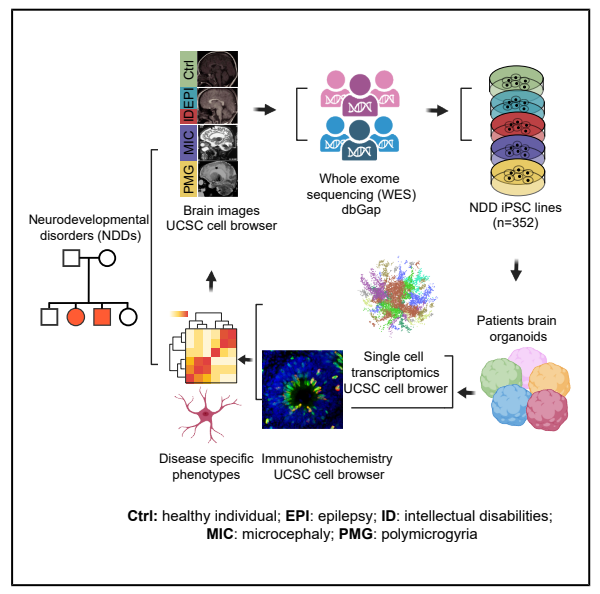
近年来,人源诱导多能干细胞(iPSC)衍生脑类器官(human brain organoids, hBOs)成为研究人类神经发育的重要模型。它们能够在三维空间中自组织形成神经上皮、放射状胶质细胞(RGCs)、神经前体细胞(NPCs)和皮层神经元等结构。然而,大多数研究集中于个别突变或小样本,缺乏跨疾病类型、跨个体的系统比较。
因此,建立统一标准化的脑类器官资源库并系统解析不同神经发育障碍的共性与差异,成为推进该领域的重要瓶颈。
技术路线
研究采用标准化的皮层类器官诱导体系(mTeSR→神经诱导→成熟培养),在DIV28形成神经上皮结构,DIV52呈现明显皮层分层。
通过免疫组化标记关键细胞标志物(SOX2、KI67、CC3、CTIP2/TBR2、ZO1)进行表型定量分析,并结合155,000+细胞的单细胞测序数据,经UMAP聚类识别出10种主要细胞类型,进一步映射至人胎脑发育参考图谱(6–40周)。
整合免疫定量与单细胞数据构建LDA分类模型,实现在DIV52阶段以AUC>0.9的准确率区分不同神经发育疾病类别。
最后,通过CRISPR介导的同源重组(HDR)校正患者特异性突变,验证了关键表型的可恢复性,确立了疾病表型与遗传变异间的因果关系。
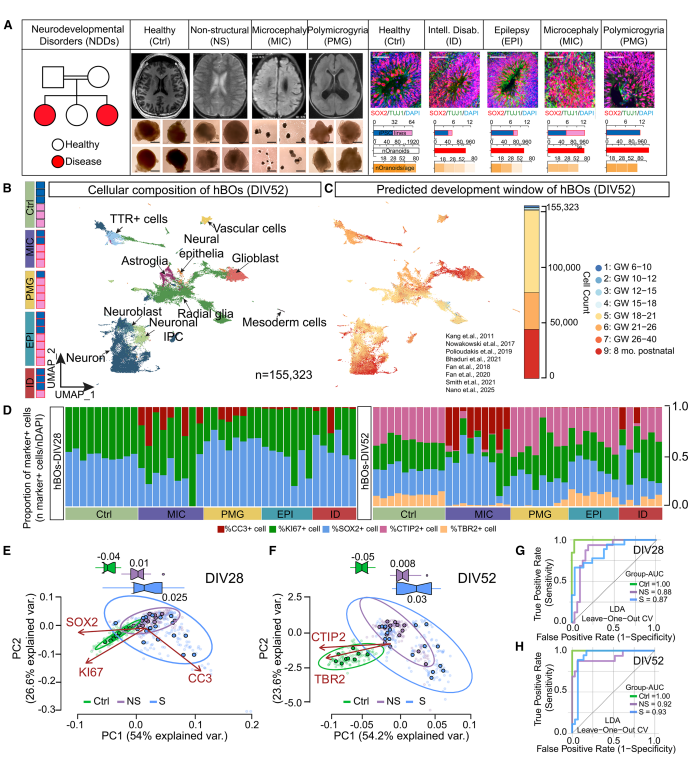
患者来源的hBOs揭示了NDD特异性细胞表型
实现了NDD脑类器官的标准化建模与分类能力验证,为后续疾病机制分析奠定基础。
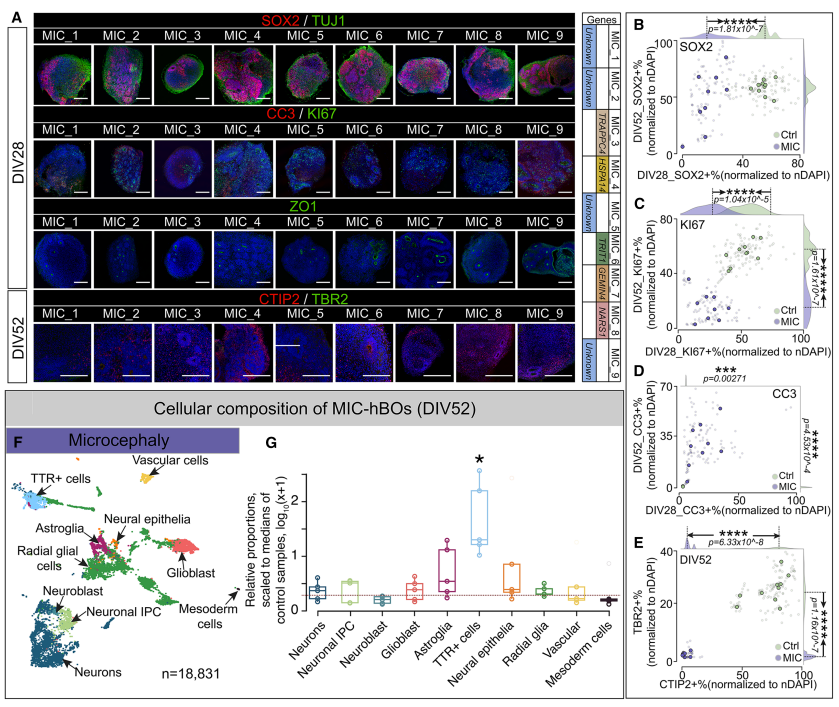
MIC患者的hBOs表现出向TTR+细胞转移的命运
MIC类器官表现为神经前体增殖不足、凋亡过多、神经谱系丢失,并伴随命运向TTR⁺非神经细胞转移。这一“命运漂移”现象提示小头畸形可能源于早期神经外胚层发育方向紊乱。
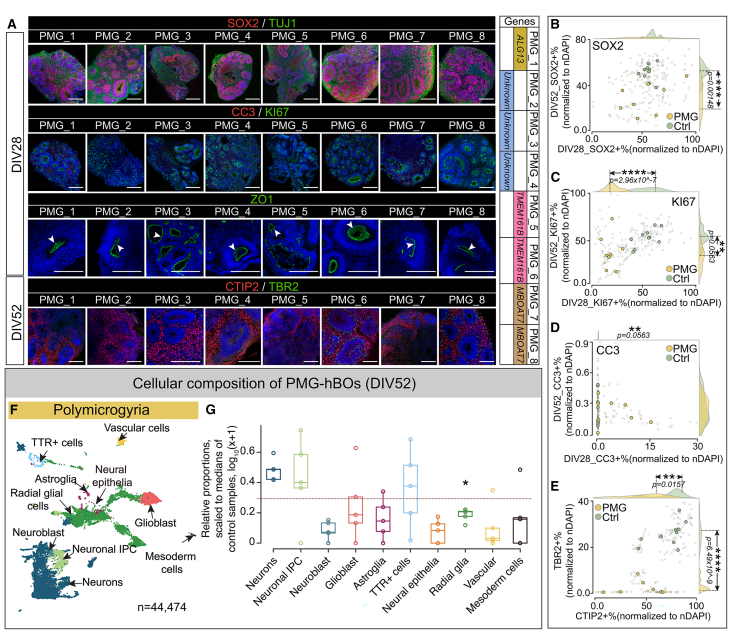
PMG患者的hBOs表现为中间祖细胞-细胞连接缺陷
PMG类器官存在细胞连接与放射状胶质支架受损,可能影响神经细胞迁移与皮层褶皱形成。这为解释临床多小脑回患者皮层过度折叠提供了细胞学依据。
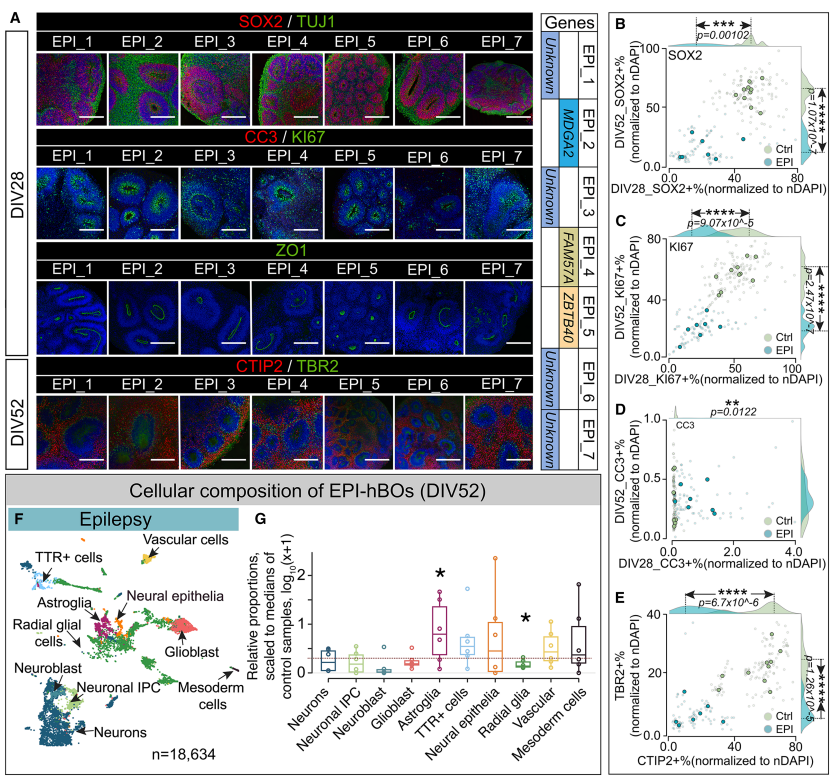
EPI患者的hBOs表现出星形胶质细胞比例的富集
EPI类器官成功重现癫痫相关星形胶质反应性增生(astrogliosis),提示脑类器官模型不仅能模拟神经元发育,还能捕捉疾病中的胶质细胞病理反应。
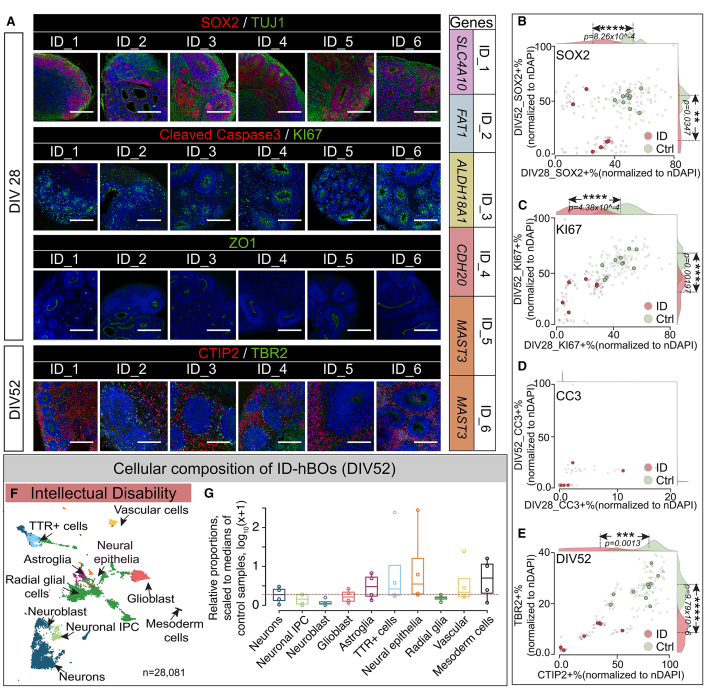
ID患者hBOs表现出过量的TTR+细胞
ID类器官揭示神经发育延迟与神经递质信号异常并存的特征,为理解智力障碍的细胞基础提供了模型。
结论
该研究首次通过大规模、跨病种的系统研究描绘了神经发育障碍(NDD)脑类器官的细胞图谱,发现各类疾病均呈现独特细胞与分子模式 ——MIC表现为神经前体增殖障碍与命运偏移(TTR + 扩增),PMG存在放射状胶质支架及细胞连接缺陷,EPI出现星形胶质细胞活化与炎症反应,ID则表现为神经递质相关通路紊乱与神经分化延迟,这些结果既揭示了疾病特异性机制,也展现了脑类器官捕捉临床表型层次多样性的潜力,而 CRISPR修复实验也为未来基因疗法或药物筛选提供了验证平台。
Nature子刊:科学家建立了一套可重复、可扩展的肾脏类器官培养体系,并将其移植到大型动物肾脏中
类器官,是在实验室里用干细胞“种”出来的微型器官。它们具备真实器官的部分结构和功能,是研究疾病、测试药物、甚至进行细胞治疗的理想模型。然而,如何大规模、高质量地生产类器官,尤其是结构复杂的肾脏类器官,一直是科学家面临的难题。
最近,一项发表于《自然·生物医学工程》的研究带来了突破性进展:科学家不仅成功实现了人源肾脏类器官的大规模、标准化生产,还首次将其移植到猪的肾脏中,并在“体外机器灌注系统”中实现了初步存活。

研究者使用了人多能干细胞作为起点,通过精准的诱导分化,将其转变为肾脏前体细胞,进而自组织成“肾脏类器官”。
为了验证其移植效果,他们选择了与人类肾脏结构相似的猪肾脏作为“宿主器官”,利用“常温机器灌注系统”模拟体内环境,进行类器官的移植与观察。整个研究分为三个阶段:
阶段一:打造高质量的肾脏类器官
研究者首先优化了培养条件,通过调控细胞密度与生长因子,诱导干细胞分化为“后期间充质”,即肾脏发育的起点。接着,他们将不同数量的细胞(500、8000、10万、25万)聚集为3D球体,在悬浮培养中观察其自组织能力。
结果发现,由500个细胞形成的类器官分化程度最高,表现出更丰富的肾单位结构(如肾小球、近端小管等),并且代谢状态更接近成熟肾脏细胞(倾向于氧化磷酸化代谢)。
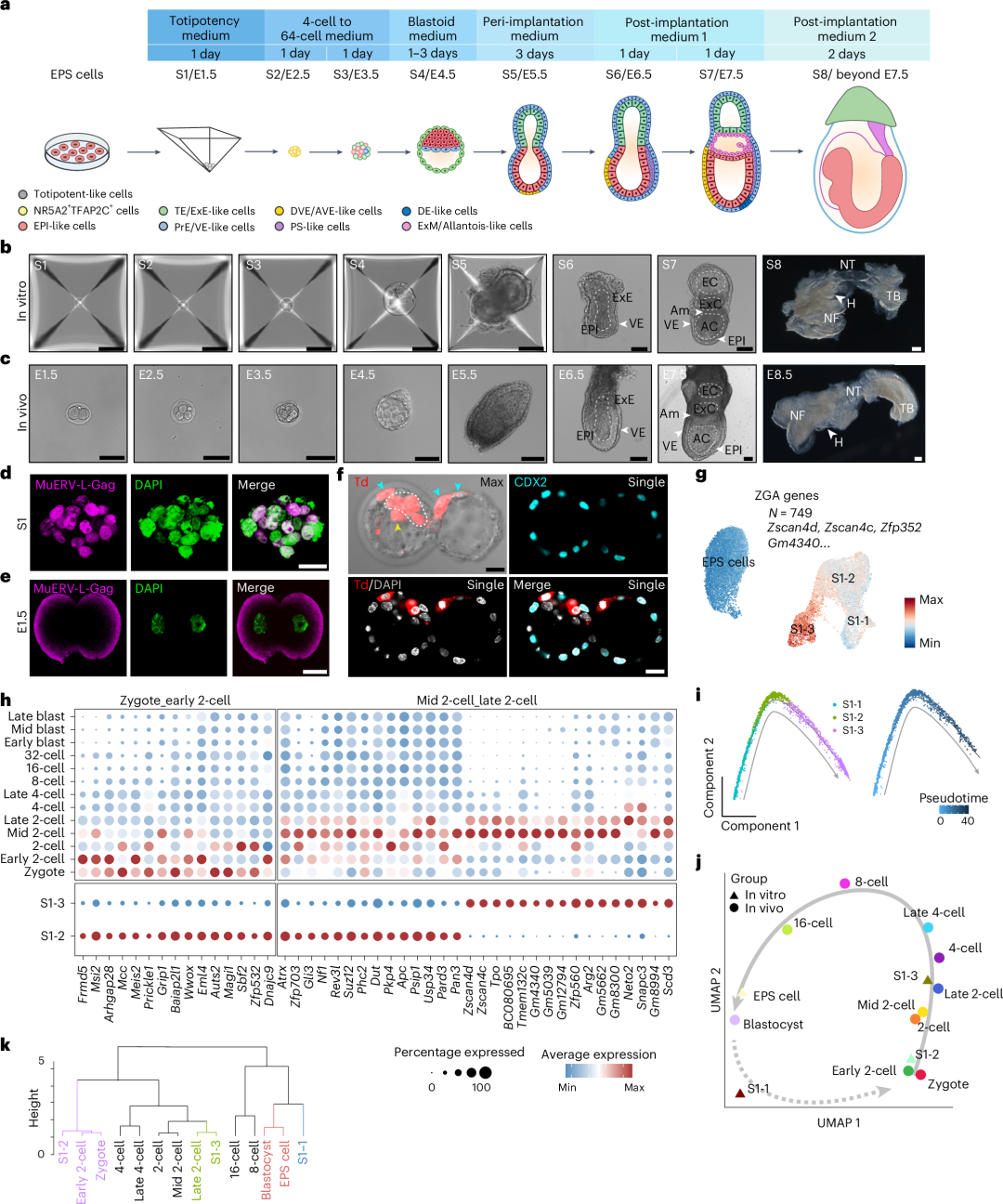
一种连续的全能性类细胞为基础的胚胎模型重现了从合子基因组激活到原肠胚形成的小鼠胚胎发生过程
阶段二:规模化生产与“荧光标记”追踪
为了实现大规模生产,研究者开发了一种微孔板培养系统,能在24孔板中一次性生成约3万个结构均一的类器官。此外,他们利用CRISPR-Cas9基因编辑技术,构建了WT1-GFP荧光报告细胞系,让肾小球前体细胞在分化过程中发出绿色荧光,便于实时追踪。
阶段三:把人类类器官移植到猪肾里
研究者将标记好的人类类器官通过肾动脉注入猪肾脏,并在体外灌注系统中维持其生理状态。结果显示:
类器官成功定植在猪肾的皮质区;
人类细胞在猪肾中存活至少48小时;
未引起明显的免疫排斥或肾功能损伤。
技术路线
它系统性地验证了定制化肾脏类器官在质量可控与规模化生产方面的可行性,并成功证明此类类器官能够在大型动物肾脏内经机器灌注系统实现短期存活——该系统作为理想的“移植前训练营”,为类器官提供了高度模拟体内的微环境。
尽管研究者坦言目前仍处于概念验证阶段,类器官的长期存活、功能成熟度及潜在免疫反应等问题尚待深入探索,但本工作无疑为肾脏再生医学的未来发展推开了关键性的窗口。
总结
近期再生医学领域的两项突破性研究,既展现了多能干细胞与类器官技术的巨大潜力,也勾勒出该领域从基础研究向临床转化的清晰路径,这些进展无疑推动再生医学向 “定制健康” 的目标迈出了重要一步,未来随着技术的不断迭代,有望为疑难疾病治疗带来更多革命性突破。