
再生医学浪潮翻涌,多能干细胞疗法凭借其巨大的应用潜力与不断涌现的突破性成果,正跃升为全球医疗领域最炙手可热的赛道。
近来,这一前沿领域传来振奋人心的进展 —— 不仅为难治性疾病的治疗开辟了全新路径,更给整个再生医学的发展注入了强劲动能,让攻克疑难病症的希望愈发清晰。
上海交大突破性研究:iPS 细胞囊泡让 NK 细胞 “返老还童”,恢复其抗癌功能
近日,上海交通大学附属第六人民医院骨科 extremity 显微外科研究所的研究团队在国际知名期刊Stem Cell Research & Therapy发表了一项突破性研究成果。
该研究首次证实,诱导多能干细胞来源的小细胞外囊泡(iPSC-sEVs)能够通过靶向调控 CISH-STAT3 信号通路,有效逆转自然杀伤细胞(NK 细胞)的衰老过程,恢复其抗癌功能。
这一发现为解决老年人免疫功能衰退、提高老年癌症患者治疗效果提供了全新的无细胞治疗策略,有望推动衰老相关疾病治疗领域的重大变革。

此前已有研究表明,干细胞来源的小细胞外囊泡(sEVs)具有抗衰潜力,能够改善多种衰老相关疾病,但它们对 NK 细胞衰老的调控作用及机制一直不明确。
为了探索 iPSC-sEVs 对 NK 细胞衰老的影响,研究团队开展了系统的实验。
技术路线
动物实验中,12 月龄(相当于人类老年阶段)自然衰老 C57 小鼠经尾静脉输注 iPSC-sEVs 6 个月后,毛发、体重更接近年轻小鼠,脾脏 NK 细胞的衰老标志物表达(γH2AX、p21)及 β- 半乳糖苷酶(SA-β-Gal)活性显著降低,且 “年轻化” 的 NK 细胞杀伤肿瘤细胞能力增强,能协同其他免疫细胞抑制肿瘤生长。
体外实验中,iPSC-sEVs 可逆转 D - 半乳糖诱导的 NK92 细胞衰老,恢复细胞周期,降低衰老相关蛋白表达,提升功能亚型 CD56bright NK 细胞比例,恢复其对 K562 淋巴瘤细胞的杀伤能力。
机制层面,研究人员通过慢病毒转染构建了 CISH 过表达的 NK92 细胞系,结果发现这些细胞会出现明显的衰老特征,细胞毒性显著下降,且 STAT3 磷酸化水平降低;反之,使用 STAT3 激活剂处理衰老 NK 细胞,则能有效改善其衰老表型。更关键的是,当同时使用 STAT3 抑制剂时,iPSC-sEVs 的抗衰效果会被完全阻断,这直接证实了 CISH-STAT3 通路是 iPSC-sEVs 调控 NK 细胞衰老的核心机制。
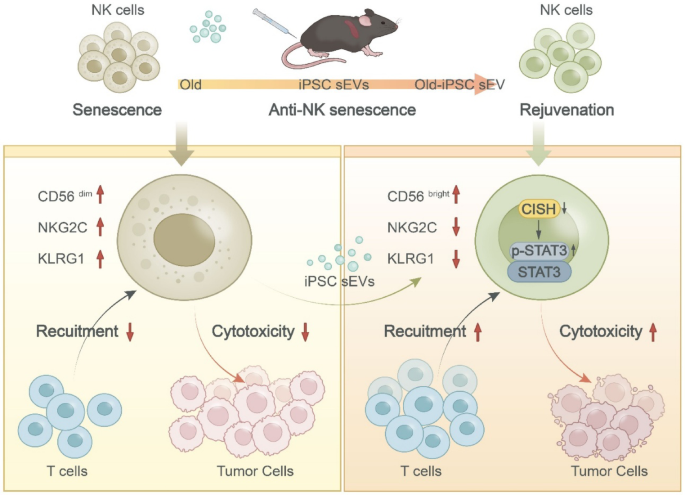
图形摘要
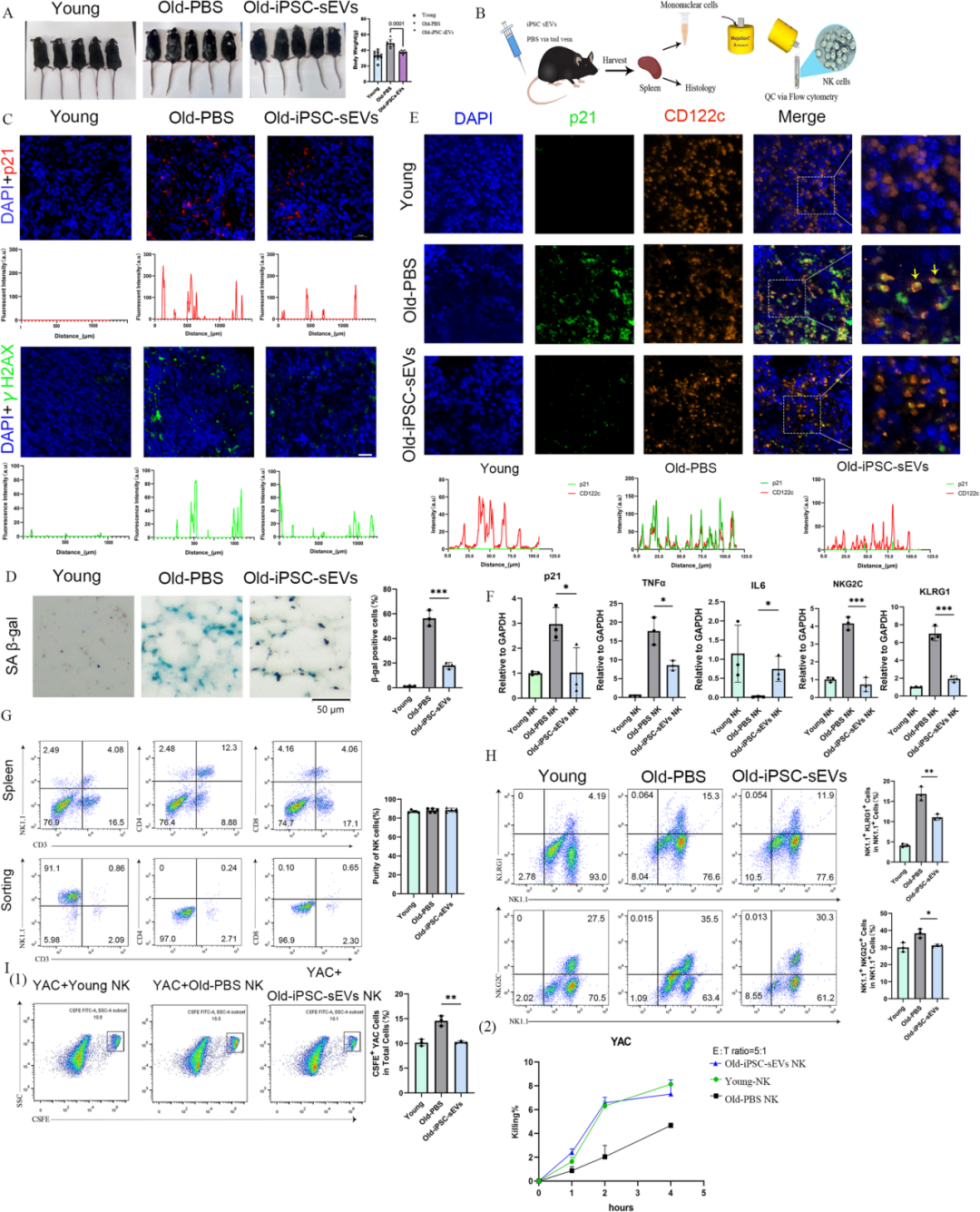
iPSCs 来源的 sEVs 通过靶向 CISH-STAT3 通路改善 NK 细胞衰老
结论
作为一种无细胞治疗剂,iPSC-sEVs 相比传统干细胞治疗具有独特的优势:它们体积小、免疫原性低,不会引发免疫排斥反应;且易于制备、储存和运输,能够标准化生产,这些特点使其在临床转化中更具可行性。
研究团队表示,该研究不仅揭示了 iPSC-sEVs 逆转 NK 细胞衰老的分子机制,更可为临床治疗提供新思路与新工具。未来,iPSC-sEVs 有望成为老年癌症新型疗法,通过静脉输注改善老年患者 NK 细胞功能、提升肿瘤免疫治疗效果,还可能用于治疗其他炎症相关衰老疾病,为延缓免疫衰老、提升老年人健康水平提供新方案。
日本团队用外周血培育 iPS 细胞,MDM4 成核心推手,安全适配个性化治疗
近期,京都大学 iPS 细胞研究与应用中心(CiRA)联合大阪大学、东京大学等机构的研究团队,在国际知名学术期刊Scientific Reports上发表了一项重要研究成果。
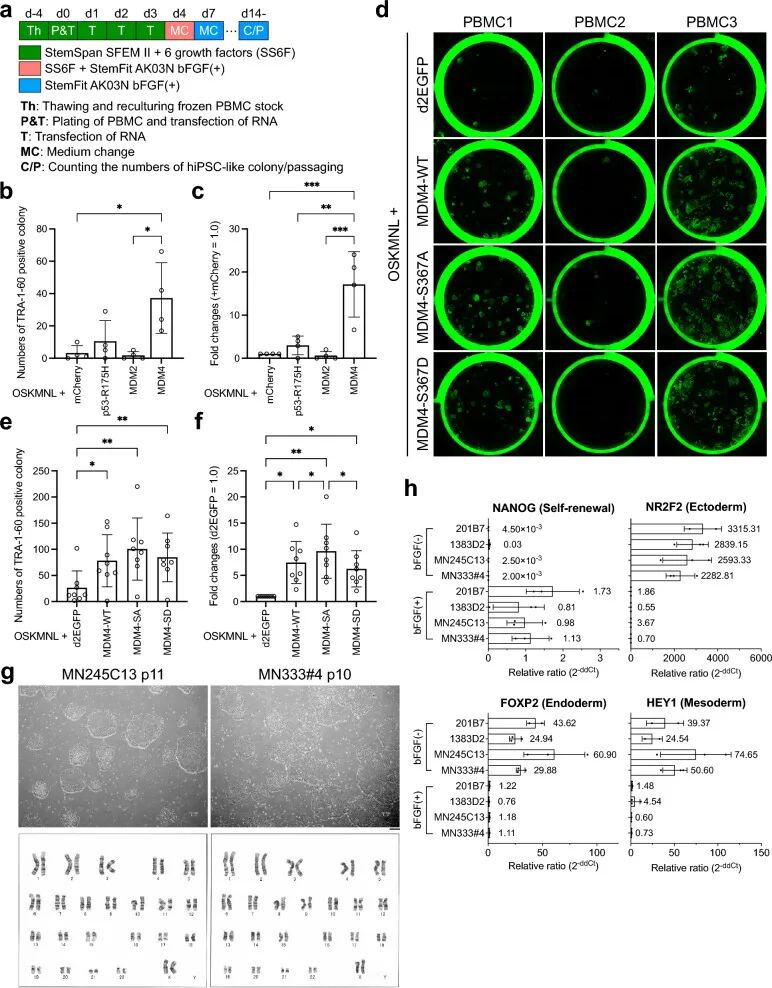
该团队成功开发出一种利用合成 RNA 从人体外周血单核细胞(PBMCs)高效培育诱导多能干细胞(iPS 细胞)的新方法,发现抑制 p53 蛋白功能的 MDM4 分子能显著提升细胞重编程效率,为再生医学和个性化医疗的发展开辟了新路径。
iPS 细胞多从皮肤成纤维细胞或血液内皮祖细胞中培育,但皮肤活检具有侵入性,而血液来源的 PBMCs 虽易获取,却始终缺乏成熟的 RNA 介导重编程技术,且相关分子机制尚不明确。
“如果能从容易获取的血液细胞中快速培育出高质量 iPS 细胞,将极大推动再生医学的临床转化。” 研究负责人、京都大学中川雅人教授表示。基于这一目标,团队将研究焦点放在了 PBMCs 上,这类细胞可从常规血液样本中分离,获取过程仅需一小时,且对人体几乎无损伤,是理想的临床细胞来源。
技术路线
研究团队首先验证了合成 RNA 在皮肤成纤维细胞重编程中的有效性,发现至少需要两次 RNA 转染才能成功培育出 iPS 细胞。随后,他们将这一技术拓展到 PBMCs,通过优化培养基配方和转染流程,实现了从血液细胞到 iPS 细胞的直接转化。更关键的是,团队发现了一个核心调控因子 ——MDM4 蛋白。
MDM4 是一种天然抑制 p53 蛋白功能的分子,而 p53 蛋白过度激活会阻碍细胞重编程过程。实验显示,在 PBMCs 重编程中加入 MDM4 的 mRNA 后,TRA-1–60 阳性菌落(iPS 细胞标志物)数量显著增加,而这一效果在皮肤成纤维细胞中并不明显。进一步研究发现,MDM4 的 S367A 突变体效果更佳 —— 该突变体可抵抗泛素化降解,能更持久地抑制 p53 活性,即使在重编程效率极低的 PBMC 样本中,也能成功诱导出 iPS 细胞菌落。
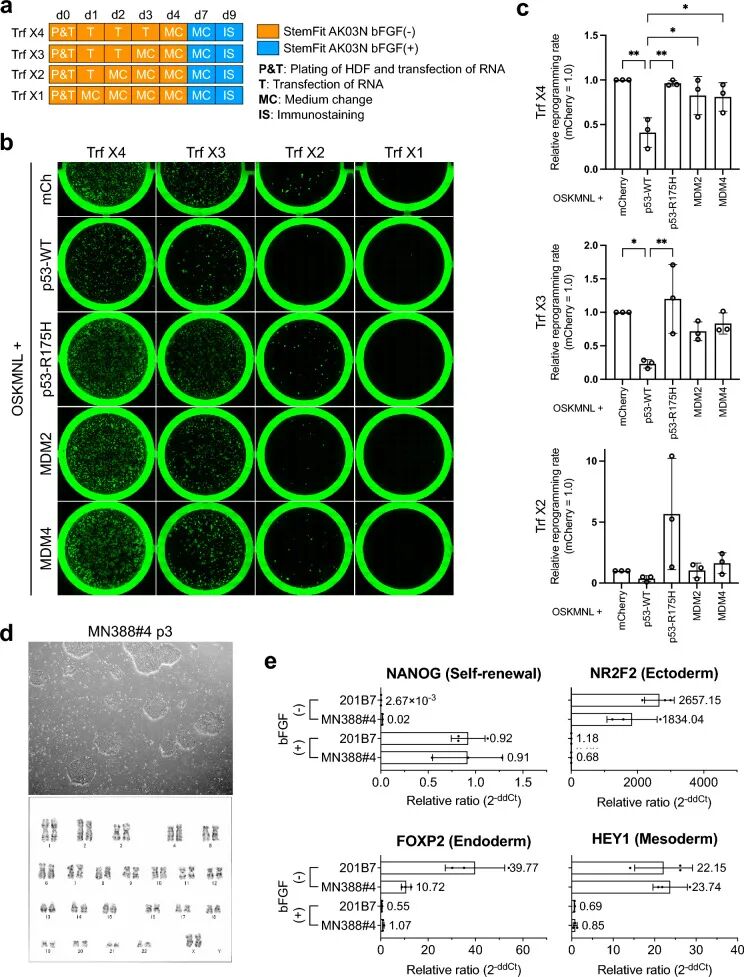
利用合成 RNA 从 HDFs 生成 iPS 细胞
合成 RNA 转染后不会在细胞内残留,也不会整合到基因组中,避免了病毒载体或质粒载体可能带来的基因插入风险。培育出的 iPS 细胞不仅具有典型的多能干细胞形态和正常 karyotype(染色体核型),还能成功分化为外胚层、内胚层、中胚层细胞,尤其在角膜上皮细胞分化实验中,表现出良好的临床应用潜力。
利用合成 RNA 从 PBMC 中生成 iPS 细胞
与现有技术相比,该方法具有三大显著优势:一是细胞来源便捷,仅需少量血液即可分离 PBMCs,无需侵入性操作;二是重编程效率高,MDM4 的加入使转化成功率大幅提升,且适用于不同供体的血液样本;三是安全性高,合成 RNA 无基因组整合风险,符合临床应用标准。
结论
这项研究不仅构建了高效的 iPS 细胞培育新方案,更关键的是为个性化医疗的落地筑牢了技术根基。
“血液样本获取便捷,且采集后可直接用于 iPS 细胞培育,这一突破意味着未来有望实现‘抽血即治疗’的个性化医疗新模式。” 中川雅人教授展望道。比如,针对遗传性疾病患者,可从其自身血液中培育 iPS 细胞,再诱导分化为病变组织的替代细胞,从根源上规避免疫排斥风险;在药物研发领域,基于患者特异性 iPS 细胞构建的疾病模型,能更精准地复刻病理状态,大幅提升药物筛选的效率与成功率。
总结
这两项突破共同勾勒再生医学新图景:更安全、高效、可标准化的多能干细胞技术,正把衰老与疑难疾病的精准治疗带入现实,为全球老龄化社会开启“重启健康”的加速键。