
再生医学浪潮翻涌,多能干细胞疗法凭借其巨大的应用潜力与不断涌现的突破性成果,正跃升为全球医疗领域最炙手可热的赛道。
近来,这一前沿领域传来振奋人心的进展 —— 不仅为难治性疾病的治疗开辟了全新路径,更给整个再生医学的发展注入了强劲动能,让攻克疑难病症的希望愈发清晰。
北京大学邓宏魁等团队:利用类全能干细胞构建模拟 E1.5-7.5 小鼠胚胎发育的新模型
近期,北京大学基础医学院徐君、邓宏魁;北京大学生命科学学院李程和北京大学药学院关景洋团队在 Nature Cell Biology 上发表了题为 A continuous totipotent-like cell-based embryo model recapitulates mouse embryogenesis from zygotic genome activation to gastrulation 的研究论文。
该研究开发出一套新型的小鼠类全能干细胞诱导与维持体系,并基于此通过分阶段诱导的策略,成功构建了可在体外全程模拟小鼠胚胎期 1.5 天至 7.5 天(E1.5-E7.5)发育的类胚胎模型。在诱导体系的终点,模型展现出早期器官发生的迹象。

干细胞来源的类胚胎模型为探索哺乳动物早期胚胎发育提供了强有力的体外研究平台。目前,通过多能干细胞等早期干细胞的自组装或共组装,研究者已能在体外建立类似囊胚、原肠胚甚至器官发生期的类胚胎结构。
然而,现有模型多聚焦于特定发育阶段的模拟。如何构建在体外连续重现小鼠胚胎从着床前至着床后完整发育轨迹的类胚胎模型,仍然是类胚胎研究亟待突破的关键问题之一。
技术路线
研究团队首先针对小鼠 TPS 细胞全能性网络激活缓慢、增殖能力有限的问题,以小鼠 EPS 细胞为起点开展化学小分子筛选,最终鉴定出一个新的小分子组合(CD1530,CHIR-99021,PD0325901,Elvitegravir)。
该组合可在 48 小时内高效诱导 EPS 细胞快速建立全能性网络,并显著提升细胞增殖能力,使其倍增时间接近小鼠早期胚胎的卵裂周期。此外,转录组分析与体内嵌合实验均证实,经该条件诱导的类全能干细胞具备典型的全能性分子特征与双向发育潜能,并可在体外实现长期稳定维持。
基于这一新型诱导的类全能干细胞,团队进一步建立了分阶段诱导类胚胎模型的体系,成功实现了对 E1.5 至 E7.5 小鼠胚胎发育关键事件的全程模拟,包括:
(1)2 细胞期合子基因组激活;
(2)4-8 细胞期双向谱系关键转录因子 Tfap2c 和 Nr5a2 的共表达;
(3)16-64 细胞期胚内与胚外谱系特化;
(4)E4.5 囊胚形成;
(5)E5.5-E6.5 着床后胚胎卵圆柱结构(Egg cylinder)形成及胚胎轴向建立;
(6)E7.5 原条形成及胚层特化等原肠运动(Gastrulation)过程。
通过免疫荧光染色与单细胞转录组测序,研究团队从多个维度验证了该模型在结构与基因表达层面高度重现了自然胚胎的关键发育事件。
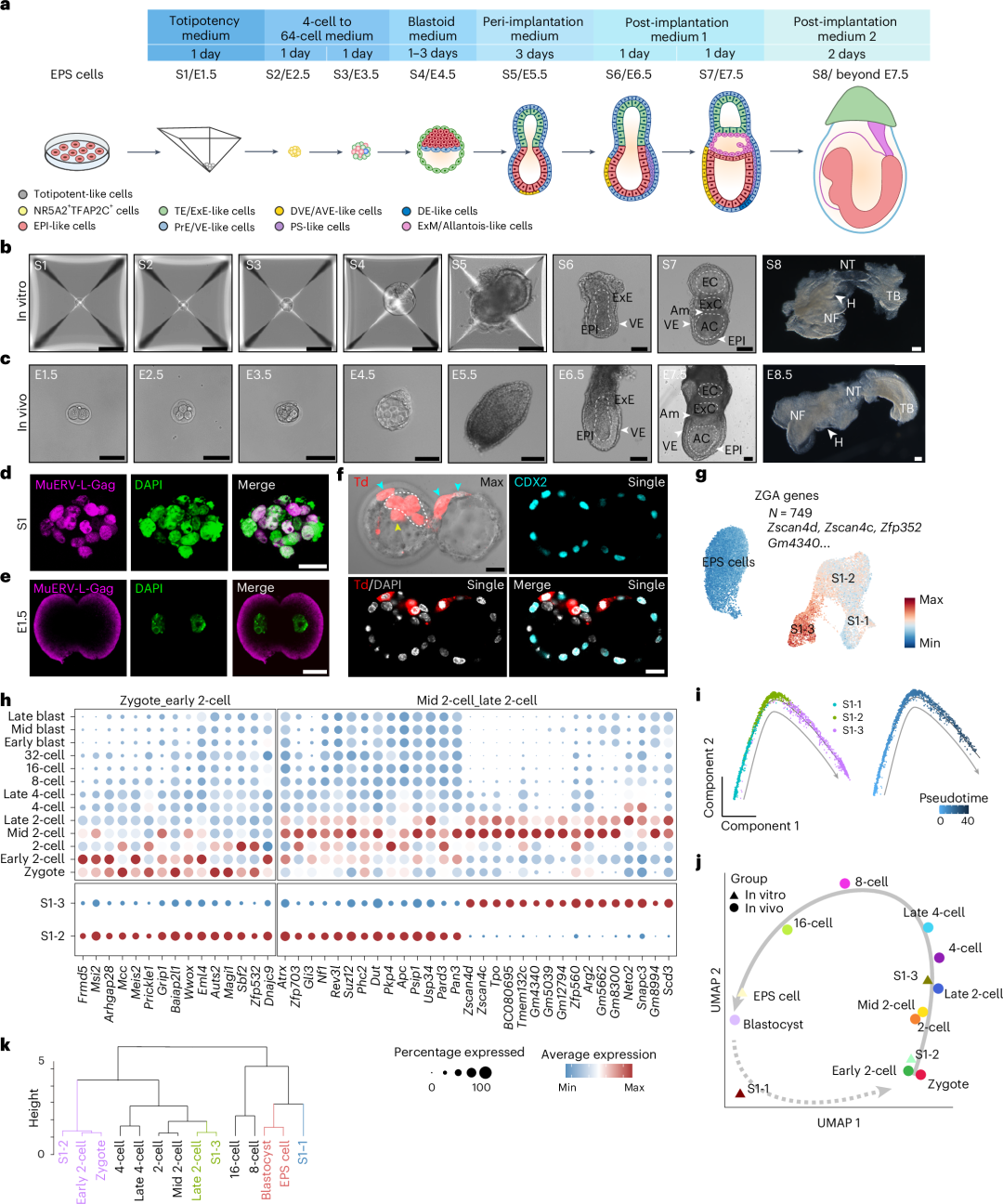
化学诱导的全能样细胞捕获了小鼠双细胞胚胎的关键特征
进一步分析不同诱导阶段的单细胞转录组数据,研究团队证实该模型在体外能够再现从 2 细胞期向原肠胚阶段演进的连续发育轨迹。
模型还成功模拟了胚内与胚外谱系的分化进程,在类囊胚阶段清晰呈现上胚层、原始内胚层与胚外滋养层的谱系分离,并展示出各谱系在后续发育中的延续性。
此外,通过特定信号通路的小分子干扰实验,研究团队发现该模型对发育扰动的响应与自然胚胎高度一致,初步证明其可用于探索早期胚胎发育的调控机制。
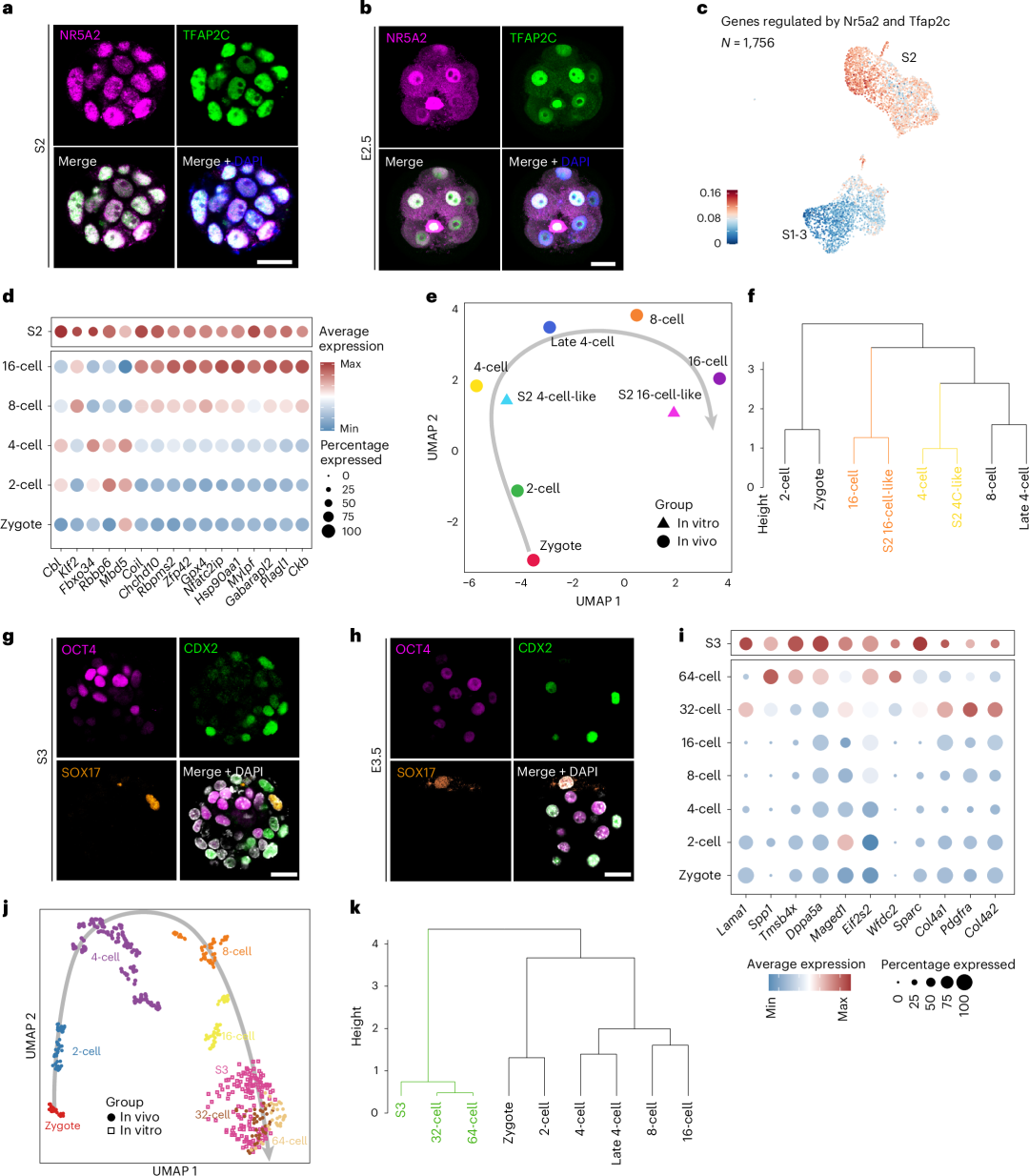
全能样细胞衍生的聚集体类似于 4 细胞到 64 细胞胚胎阶段的小鼠早期胚胎
值得注意的是,在滚筒培养体系中,部分 E7.5 样类胚胎结构可进一步发育为形态上类似 E8.5 胚胎的结构。免疫荧光分析显示,这些 E8.5 样结构中出现了脑区、心管和尾芽等早期器官发生的典型特征。单细胞转录组分析进一步表明,这些 E8.5 样结构中涵盖了 E8.5 自然胚胎中的大多数细胞谱系,且其转录组特征与体内对应谱系高度相似。
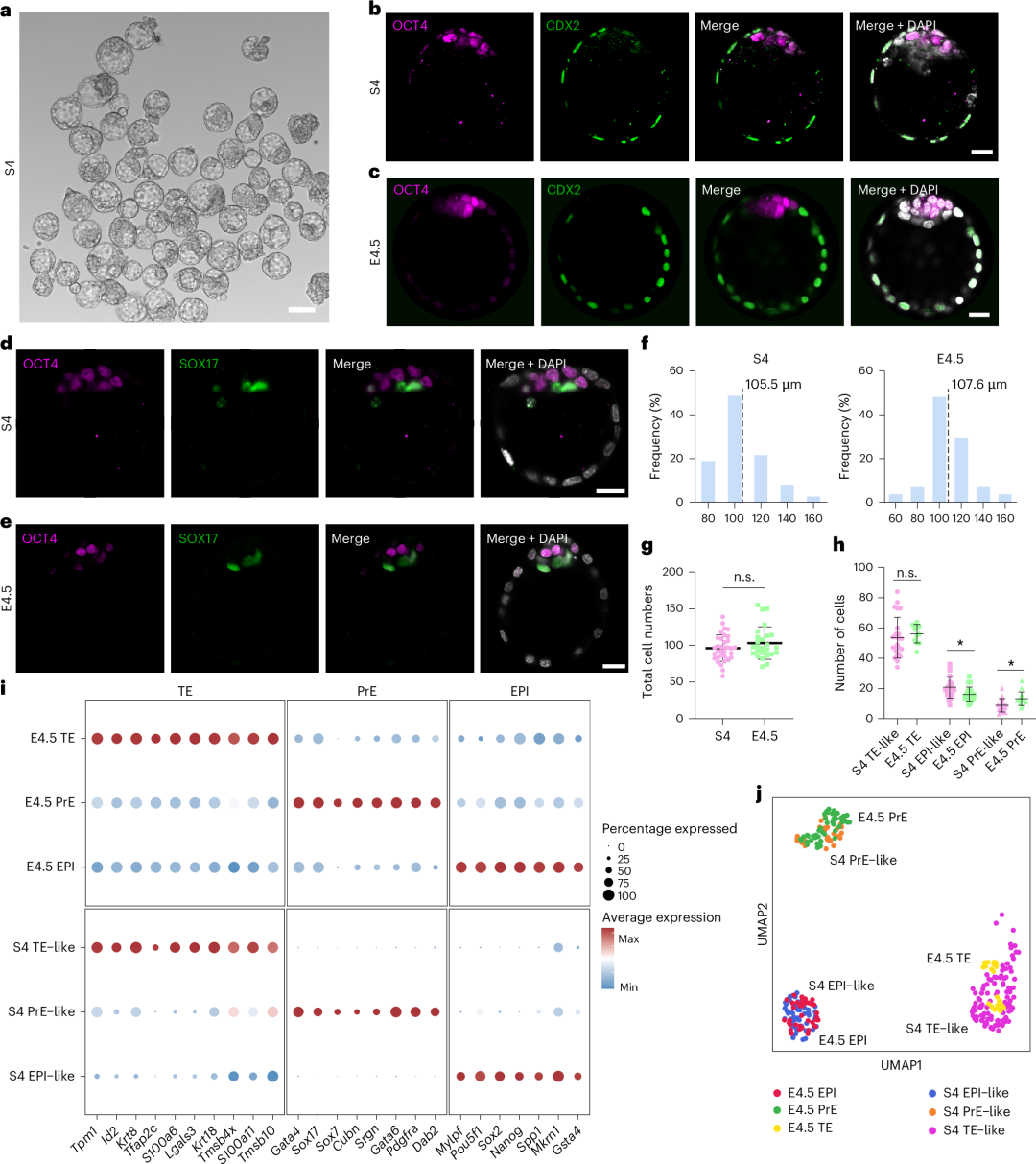
化学诱导的全能样细胞诱导囊胚样结构
结论
综上所述,该研究基于新型类全能干细胞成功构建了可在体外连续重现从合子基因组激活至原肠运动完成的类胚胎模型。该工作不仅建立了小鼠类全能干细胞的高效诱导新方法,也为在体外深入研究小鼠早期胚胎发育提供了全新平台,向利用早期干细胞构建完整生命个体的终极目标更进一步。
日本团队:构建出能精准模拟肝细胞与肝星状细胞(HSCs)相互作用的类器官模型(iHSO)
近日,日本东京科学研究所团队在 Stem Cell Reports 期刊发表重磅研究成果:借助人类诱导多能干细胞(iPS细胞),成功构建出全球首个可精准模拟肝细胞与肝星状细胞(HSCs)动态互作微环境的类器官模型(iHSO)。
这一创新突破不仅为解析肝纤维化的核心发病机制提供了全新工具,更将为抗纤维化药物研发与肝病临床治疗带来革命性变革。
肝脏健康状态下肝星状细胞(HSCs)处于静止期,储存维生素 A 、维持肝脏稳态;肝细胞反复受损会激活 HSCs ,使其转化为产细胞外基质的肌成纤维细胞,基质过度沉积引发肝纤维化,进而恶化至肝硬化、肝癌。由于肝细胞与 HSCs 的精确交流机制尚未明确,且传统动物模型因物种差异无法还原人类细胞真实行为,研究进展长期受阻。
技术路线
研究团队成功用人类 iPS 细胞分化出肝细胞样细胞(iPS-Heps)和星状细胞样细胞(iPS-HSCs),并将它们放在三维环境中共同培养,最终形成了独特的类器官—— iHSO 。
这种 “微缩肝脏” 最神奇的地方在于其天然的结构:星状细胞会自动包裹在肝细胞核心周围,完美复刻了人体肝脏的细胞排布模式。更重要的是,三维培养环境能有效抑制 iPS-HSCs 的体外自发激活,让它们更贴近体内静止状态,解决了传统二维培养无法模拟生理环境的痛点。
在 iHSO 类器官模型(微缩肝脏)中,研究人员明确了肝细胞与肝星状细胞的通讯机制:细胞黏附分子 ICAM-1 与细胞因子 IL-1β 构成两者相互作用的核心信号轴。实验显示,该模型中的肝星状细胞可维持静止状态及富含细胞因子的表型,并通过上述信号轴显著促进肝细胞增殖,这一促增殖效应在传统原代肝细胞共培养模型中未被观察到,体现了 iHSO 模型的独特优势。进一步研究证实,两者的“通讯”依赖直接细胞接触,仅通过条件培养基无法重现该表型变化,这也解释了以往体外研究难以还原体内肝脏真实修复过程的原因。
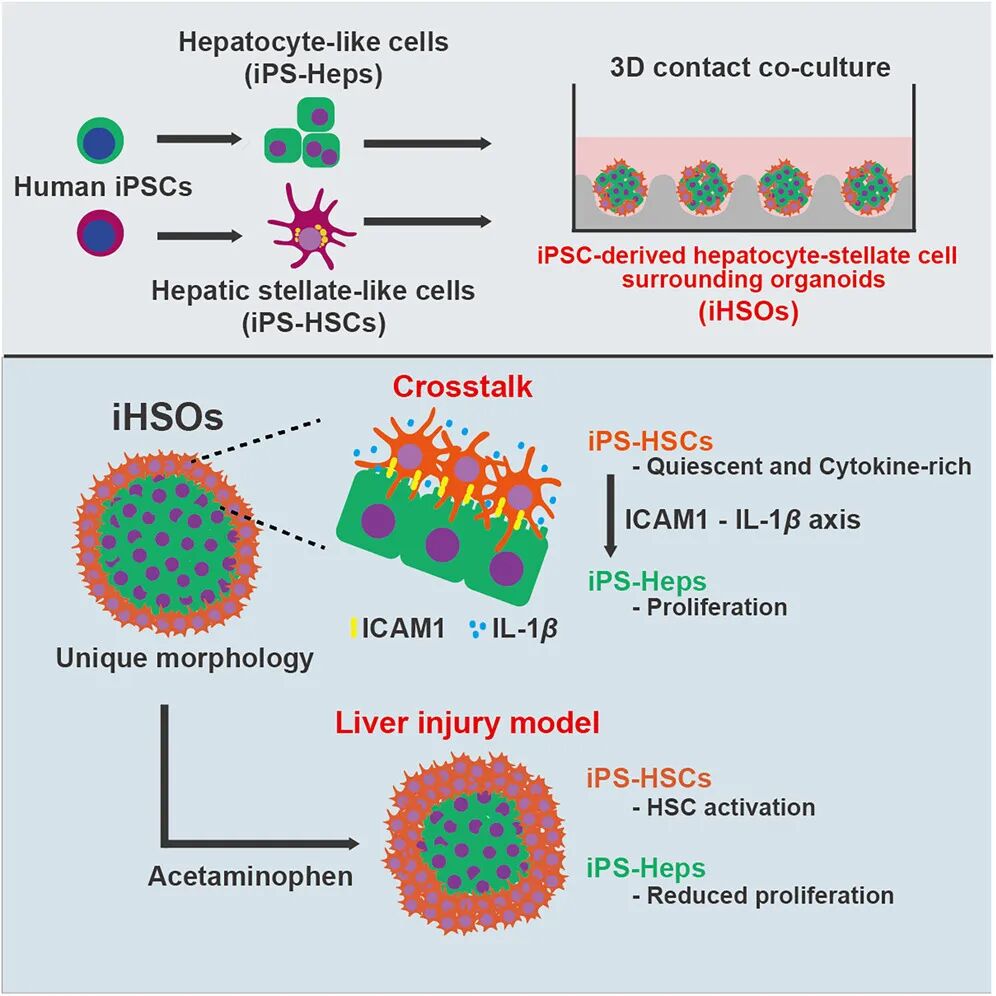
图形摘要
为验证 iHSO 的临床应用价值,研究团队用常见肝毒性药物乙酰氨基酚(APAP)处理类器官,成功模拟出肝细胞损伤诱导星状细胞激活的完整过程:随着 APAP 浓度升高,肝细胞区域明显缩小,星状细胞区域则显著扩大,同时静止期标志物(NGFR、CYGB 等)表达下降,激活标志物(ACTA2、TIMP1)表达升高,甚至出现细胞外基质沉积增加的纤维化特征。这完美再现了人类肝脏从损伤到纤维化启动的全过程。更重要的是,这种激活仅在肝细胞与星状细胞共培养的 iHSO 中出现,星状细胞单独培养时无此变化,进一步证明了该模型能精准还原细胞间相互作用介导的病理过程。
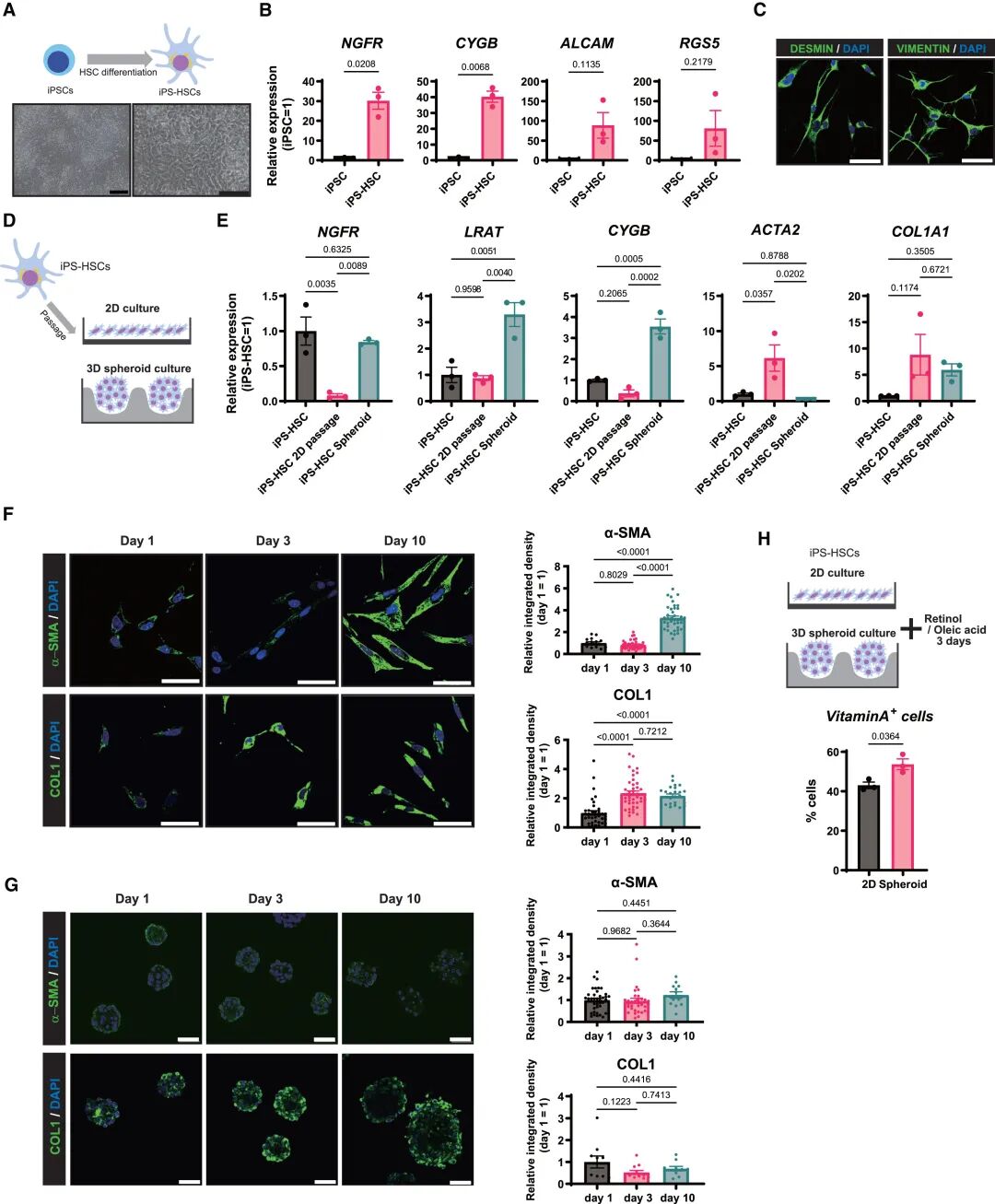
3D 培养可部分抑制 iPS - hsc 的体外活化
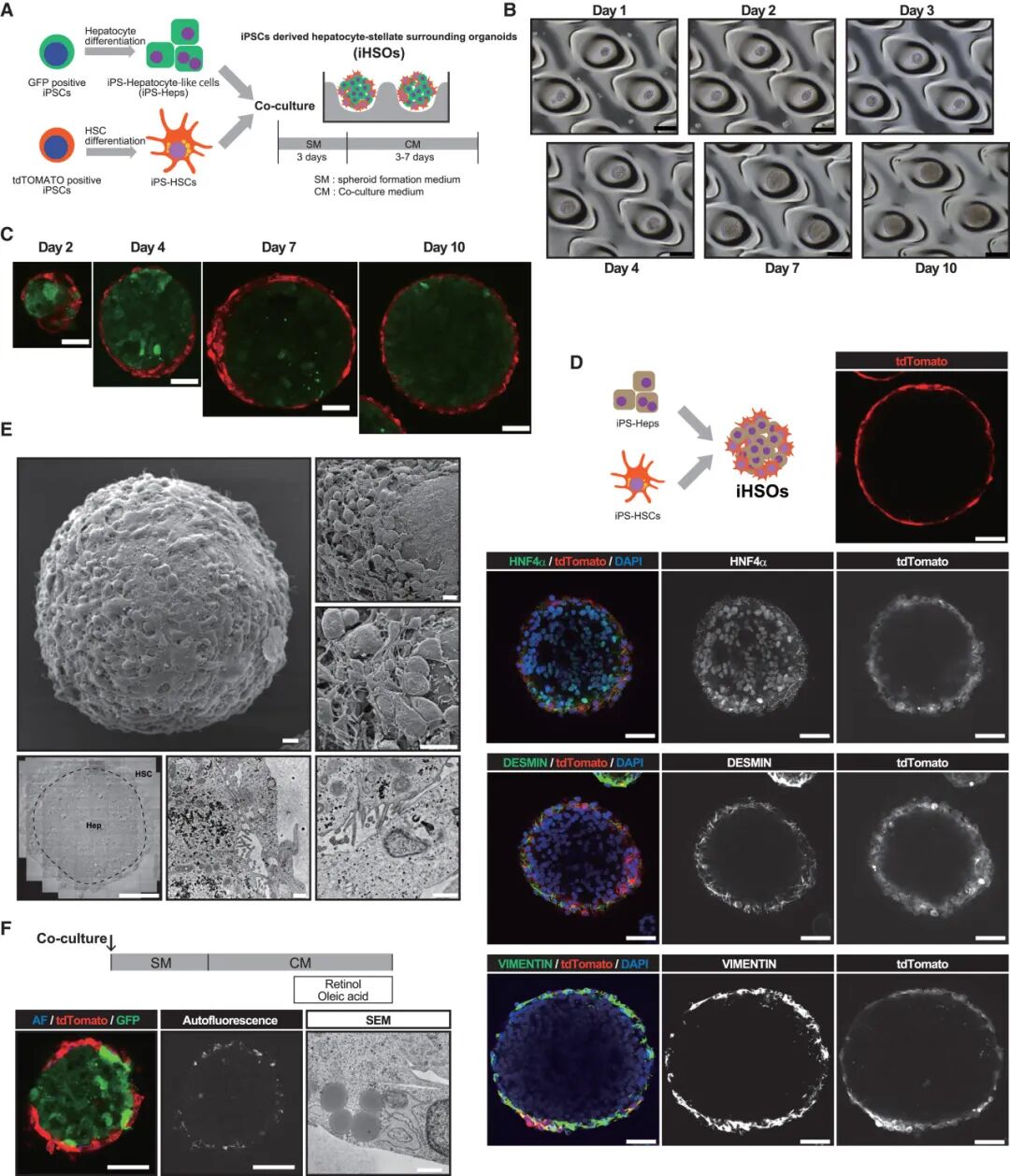
由 iPS - hsc 和 iPS-Heps 组成的新类器官的建立
结论
iHSO 类器官模型的出现,为肝病研究与抗纤维化药物开发提供了关键支撑。该模型可助力科研人员直观观察肝纤维化的启动与进展机制,同时适用于高通量药物筛选,能够快速筛选出可阻止肝星状细胞激活、促进肝细胞再生或逆转细胞外基质沉积的候选化合物。
总结
这些成果不仅彰显了干细胞与类器官技术在生命科学基础研究中的核心价值,更推动再生医学向 “精准模拟、高效转化” 的方向迈出关键一步,未来有望在发育相关疾病、肝病等疑难病症的机制探索与临床治疗中释放更大潜能,持续为健康未来注入创新动能。